Introducción
El árbol Melaleuca quinquenervia (Cav.) S. T. Blake (Myrtaceae), conocido como corteza de papel, es una especie invasora agresiva en varios ecosistemas del sur de Florida, incluyendo los Everglades. Melaleuca está considerado una plaga porque desplaza la vegetación nativa y degrada el hábitat de especies silvestres; además aumenta el peligro de incendios y puede causar problemas a la salud humana (Rayamajhi et al. 2002). El Departamento de Agricultura de los Estados Unidos (USDA) y el Servicio de Investigación Agrícola (ARS), bajo permiso federal y estatal, introdujeron el psílido Boreioglycaspis melaleucae en Florida en el Condado de Broward, en Febrero del 2002 como un agente potencial de control biológico de melaleuca.

Credit: Susan Wright, USDA
Distribución
Boreioglycaspis melaleucae es nativo de Australia y ha sido colectado en todos los estados excepto en el sur de Australia (Burckhardt 1991). Los especímenes liberados en Florida son originales del sureste de Queensland. Hasta Octubre del 2002, el psílido de melaleuca ha sido liberado en cinco condados de Florida: Broward, Collier, Lee, Miami-Dade y Palm Beach, y se conoce que se ha establecido en todos estos condados excepto en Palm Beach. Este insecto será introducido o dispersado naturalmente a todos los 22 condados en el centro y sur de Florida donde se encuentran las infestaciones de melaleuca.
Descripción
Adultos
Los adultos de Boreioglycaspis son pequeños, cerca de 3 mm de largo, y son imperceptibles, de color pálido entre amarillo-naranja a blanco con marcas grises a negras. La punta de las antenas son grises a negras y las alas son transparentes con venas amarillas. Los ojos compuestos son usualmente verde pálido con una mancha obscura distintiva entre ellos, no obstante varios tonos de rojo han sido observados en el laboratorio; sus tres ocelos son de color naranja intenso, de los cuales los dos ocelos dorsales son más notorios. Dos apéndices con forma de dedos o 'genas' se extienden desde la parte baja de los ojos hacia afuera y apuntando ligeramente hacia abajo. Cuando están descansando o alimentándose, el cuerpo está paralelo a la superficie de la hoja o el tallo, a diferencia del psílido Asiático de los cítricos, Diaphorina citri, que mantiene su cuerpo en un ángulo de 45 grados.

Credit: Susan Wright, USDA

Credit: Jeffrey Lotz, DPI
Los machos y hembras pueden ser fácilmente reconocidos por la forma de los abdómenes y por los genitales del macho. El abdomen del macho tiene la forma de un triángulo isósceles alongado cuando es visto desde arriba y terminado en unas tenazas (paramero) muy particulares, los cuales son muy aparentes cuando se los mira lateralmente. El abdomen de la hembra es más rectangular, disminuyendo gradualmente hacia la punta; las membranas pleurales son usualmente expandidas, parcialmente visibles desde arriba, llenos de huevos. Las hembras son generalmente más grandes que los machos. Los adultos arrastran las alas traseras cuando caminan, y saltan o vuelan cuando son perturbados.
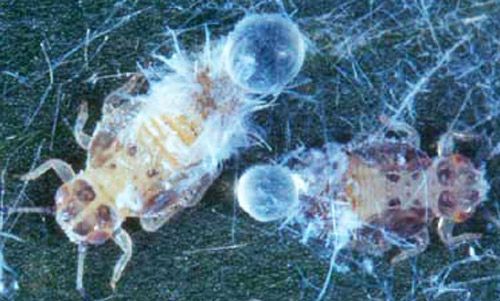
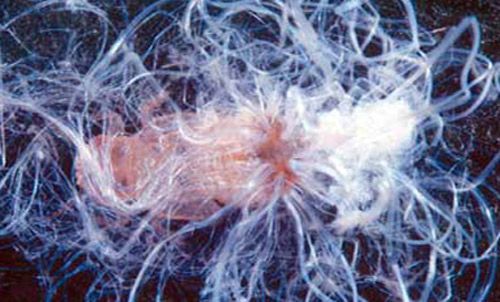
Ninfas
Las ninfas, excepto los neonatos (insectos recién nacidos), son sedentarias salvo cuando son perturbadas. Durante los primeros estadios de desarrollo son amarillo pálido sin marcas, pero para el quinto estadio ellos tienen marcas grises a negras en el cuerpo. Cuando se alimentan, las ninfas secretan filamentos blancos cerosos desde la placa caudal dorsal. La cera filamentosa cubre ligeramente sus cuerpos. Las ramas y hojas se cubren con estos filamentos creando una floculencia (como unos puños de hebras o lana de oveja) que indican una alta infestación. La lluvia lava la floculencia, pero las ninfas secretan más eventualmente. Además, las ninfas producen cantidades abundantes de mielecilla la cual es contenida externamente en membranas globulares cerosas; las ninfas desechan esferas llenas de mielecilla en lugares cercanos. Los adultos también secretan esferas de mielecilla, pero ellos las esparcen más lejos de su área cercana.
Credit: Jeffrey Lotz, DPI
Credit: Susan Wright, USDA

Credit: Susan Wright, USDA
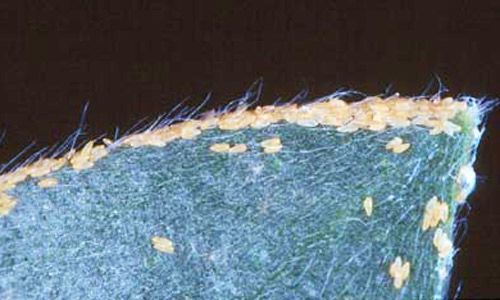
Huevos
Los huevos son de color pálido a amarillo intenso y son depositados individualmente o en grupos en las hojas y tallos de melaleuca. Los huevos están sostenidos por una proyección delgada o pedicelo el cual es insertado en la hoja.
Credit: Susan Wright, USDA
Ciclo de Vida
Las hembras depositan aproximadamente 80 huevos (Rayamajhi et al. 2002) y las nimfas eclosionan en dos o tres semanas. El estadio ninfal (cinco estadios) requiere de tres a cuatro semanas. Después de su liberación en la Florida, B. melaleucae se estableció rápidamente (Centre et al. 2006) y se dispersó a lo largo del rango de melaleuca a una tasa de aproximadamente 7 km / año (Balentine et al. 2009). El insecto está ahora ampliamente establecido, con poblaciones enormes que se desarrollan durante la estación seca de primavera en todos los tipos de hábitat. Sin embargo, las poblaciones disminuyen durante el verano, probablemente debido a las altas temperaturas en lugar de las precipitaciones (Chiarelli et al. 2011).
Importancia
Tanto los adultos como las ninfas se alimentan de la melaleuca, causando una alta mortalidad de las plántulas y la caída prematura de las hojas de los árboles maduros (Franks et al. 2006; Morath et al. 2006). Las elevadas infestaciones de psílidos también aumentan la mortalidad de los troncos de rebrote (Centre et al. 2007).
El picudo de la melaleuca, Oxyops vitiosa, el primer insecto liberado para el control biológico de melaleuca, no puede establecerse en sitios de melaleuca inundados permanentemente debido a la necesidad de suelo para la pupación. Bajo estas condiciones, el psílido B. melaleucae sigue siendo capaz de dañar gravemente la melaleuca porque este insecto completa su ciclo de vida enteramente en la copa de los árboles.
Hospederos
En Australia, se conoce que Boreioglycaspis melaleucae aparece en cuatro especies de melaleuca del complejo Melaleuca leucadendra. Estas son Melaleuca argentea, Melaleuca leucadendra, Melaleuca nervosa, y Melaleuca quinquenervia. Ninguna de estas especies son nativas del nuevo mundo. Además, en estudios de rango de hospederos realizados por el Laboratorio Australiano de Control Biológico parte del Departamento de Agricultura de los Estados Unidos (USDA), el psílido completó su desarrollo en Melaleuca viridiflora y Melaleuca nodosa, también nativos de Australia. En los estudios de rango de hospederos realizados en el Laboratorio de Control Biológico de Florida del Departamento de Agricultura y Servicios al Consumidor de Florida (FDACS), el psílido completó una vez su desarrollo en Callistemon (=Melaleuca) citrinus, la variedad de hoja ancha, la cual es una especie ornamental introducida.
Muestreos y Detección
Para muestrear Boreioglycaspis melaleucae, busque floculencia en el crecimiento más nuevo de la planta. Los adultos pueden ser colectados usando una manta de golpeo y un aspirador de insectos, o con trampas adhesivas amarillas para insectos.
Especies Similares en Florida
Boreioglycaspis melaleucae se diferencia por sus largas genas las cuales son tan largas como el vertex. La única otra especie en Florida con genas tan largas es la plaga invasiva, Glycaspis brimblecombei Moore, encontrada en Eucalyptus introducido (Halbert et al. 2001). Cuando están vivos, el morfotipo de color verde no será confundido con Boreioglycaspis melaleucae, pero el morfotipo de color marrón si podrá ser confundido. Cuando están muertos, los morfotipos de Glycaspis brimblecombei son más similares y podrán ser confundidos con Boreioglycaspis melaleucae.

Credit: Jeffrey Lotz, DPI

Credit: Susan Wright, USDA

Credit: Susan Wright, USDA
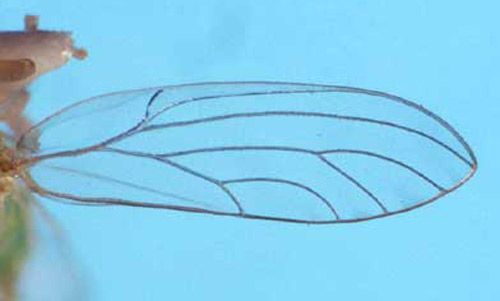
Los adultos muertos se pueden separar con la siguiente clave:
1. La longitud de la antena es menor que la mitad de la longitud del cuerpo, excluyendo las alas; la ramificación de la vena media del ala distal con respecto al punto el cual intercepta el borde del ala.... Boreioglycaspis melaleucae.
1'. La longitud de la antena es aproximadamente 3/4 de la longitud del cuerpo, excluyendo las alas; la ramificación de la vena media del ala próxima con respecto al punto el cual intercepta el borde del ala.... Glycaspis brimblecombei.

Credit: Jeffrey Lotz, DPI
Las ninfas no deberían ser confundidas cuando están en las plantas: las ninfas de Glycaspis brimblecombei forman un refugio producido por una secreción anal de carbohidratos (lerp), mientras que las ninfas de Boreioglycaspis melaleucae son cubiertas solamente por un cera algodonosa. Otro psílido introducido pero no invasivo, Blastopsylla occidentalis Taylor, encontrado en el eucalipto introducido, es morfológicamente muy diferente que Boreioglycaspis melaleucae, pero la apariencia general del adulto y la floculencia de las ninfas podría causar confusión. Este psílido es casi la mitad del tamaño de Boreioglycaspis melaleucae y no tiene genas prominentes.
Manejo
Control Biológico
El psílido debería ser una plaga solamente en Melaleuca quinquenervia; y por consiguiente, no habría necesidad de controlarlo usando control biológico. Un parasitoide ninfal Australiano, Psyllaephagus sp., (Hymenoptera: Encyrtidae) ataca Boreioglycaspis melaleucae (Purcell et al. 1997) en Australia pero fue removido de los envíos realizados a Florida. No se ha reportado la presencia de Psyllaephagus spp. en Florida, y es muy poco probables que los parásitos de psílidos nativos de Florida utilicen a los nuevos hospederos.
Control Químico
Melaleuca quinquenervia es una maleza nociva en los listados federales y estatales y no se puede comprar o mantenerla legalmente. No obstante, los dueños de propiedades con árboles de melaleuca grandes en áreas urbanas pueden alarmarse por el daño causado por los psílidos en sus árboles o por la abundancia de floculencia y mielecilla producida por las ninfas. Mientras los propietarios deberían ser alentados en remover los árboles, algunos no lo harán. En este caso, los químicos aprobados para controlar los psílidos podrían ser utilizados. Fuertes chorros de agua pueden remover las ninfas de las hojas.
Referencias
Balentine KM, Pratt, PD, Dray, Jr. FA, Rayamajhi MB, Center T. D. 2009. Geographic distribution and regional impacts of Oxyops vitiosa (Coleoptera: Curculionidae) and Boreioglycaspis melaleucae (Hemiptera: Psyllidae), biological control agents of the invasive tree Melaleuca quinquenervia. Environmental Entomology 38: 1145–1154.
Burckhardt D. 1991. Boreioglycaspis and spondyliaspidine classification (Homoptera: Psylloidea). The Raffles Bulletin of Zoology 39: 15–52.
Center TD, Pratt PD, Tipping PW, Rayamajhi M B, Van TK, Wineriter SA, Dray J, Purcell M. 2006. Field colonization, population growth, and dispersal of Boreioglycaspis melaleucae Moore, a biological control agent of the invasive tree Melaleuca quinquenervia (Cav.) Blake. Biological Control 39:363–374.
Center TD, Pratt PD, Tipping PW, Rayamajhi MB, Van TK, Wineriter SA, Dray FA. 2007. Initial impacts and field validation of host range for Boreioglycaspis melaleucae Moore (Hemiptera: Psyllidae), a biological control agent of the invasive tree Melaleuca quinquenervia (Cav.) Blake (Myrtales: Myrtaceae: Leptospermoideae). Environmental Entomology 36: 569–576.
Chiarelli RN, Pratt PD, Silvers CS, Blackwood JS, Center TD. 2011. Influence of temperature, humidity, and plant terpenoid profile on life history characteristics of Boreioglycaspis melaleucae (Hemiptera: Psyllidae), a biological control agent of the invasive tree Melaleuca quinquenervia. Annals of the Entomological Society of America 104: 488–497.
Franks SJ, Kral, AM, Pratt PD. 2006. Herbivory by introduced insects reduces growth and survival of Melaleuca quinquenervia seedlings. Environmental Entomology 35: 366–372.
Halbert SE, Gill RJ, Nisson JN. 2001. Two Eucalyptus psyllids new to Florida (Homoptera: Psyllidae). Florida Department of Agriculture & Consumer Services, Division of Plant Industry, Gainesville, Entomology Circular 407: 1–2.
Hodkinson I D. 1974. The biology of Psylloidea (Homoptera): a review. Bulletin of Entomological Research 64: 325–339.
Moore KM. 1964. Observations of some Australian forest insects. 19. Additional information on the genus Glycaspis (Homoptera: Psyllidae); erection of a new subgenus and descriptions of six new species. Proceedings of the Linnean Society of New South Wales 89: 221–234.
Moore KM. 1970. Observations of some Australian forest insects. 23. A revision of the genus Glycaspsis (Homoptera: Psyllidae) with descriptions of seventy-three new species. Australian Zoologist 15: 248–342.
Morath SU, Pratt PD, Silvers CS, Center TD. 2006. Herbivory by Boreioglycaspis melaleucae (Hemiptera: Psyllidae) accelerates foliar senescence and abscission in the invasive tree Melaleuca quinquenervia. Environmental Entomology 35: 1372–1378.
Purcell MR, Balciunas JK, Jones P. 1997. Biology and host-range of Boreioglycaspis melaleucae (Hemiptera: Psyllidae), potential biological control agent for Melaleuca quinquenervia (Myrtaceae). Environmental Entomology 26: 366–372.
Rayamajhi MB, Purcell MF, Van TK, Center TD, Pratt PD, Buckingham GR. 2002. Australian paperbark tree (Melaleuca), pp. 117–130. In Van Driesche R, Blossey B, Hoddle M, Lyon S, and Reardon R (eds.), Biological Control of Invasive Plants in the Eastern United States. USDA Forest Service Publication FHTET-2002-04. USDA Forest Service, Morgantown, West Virginia.
Wineriter SA, Buckingham GR, Frank JH. 2003. Host-range of Boreioglycaspis melaleucae Moore (Hemiptera: Psyllidae), a potential biocontrol agent of Melaleuca quinquenervia (Cav.) S.T. Blake (Myrtaceae), under quarantine. Biological Control 27: 273–292.