Introducción
El propósito de esta publicación es proveer un perfil a profundidad del ácaro de la erinosis del lichi (LEM, por sus siglas en inglés). Está dirigido a personas interesadas del público en general con algo de conocimiento de biología, así como a una audiencia académica.
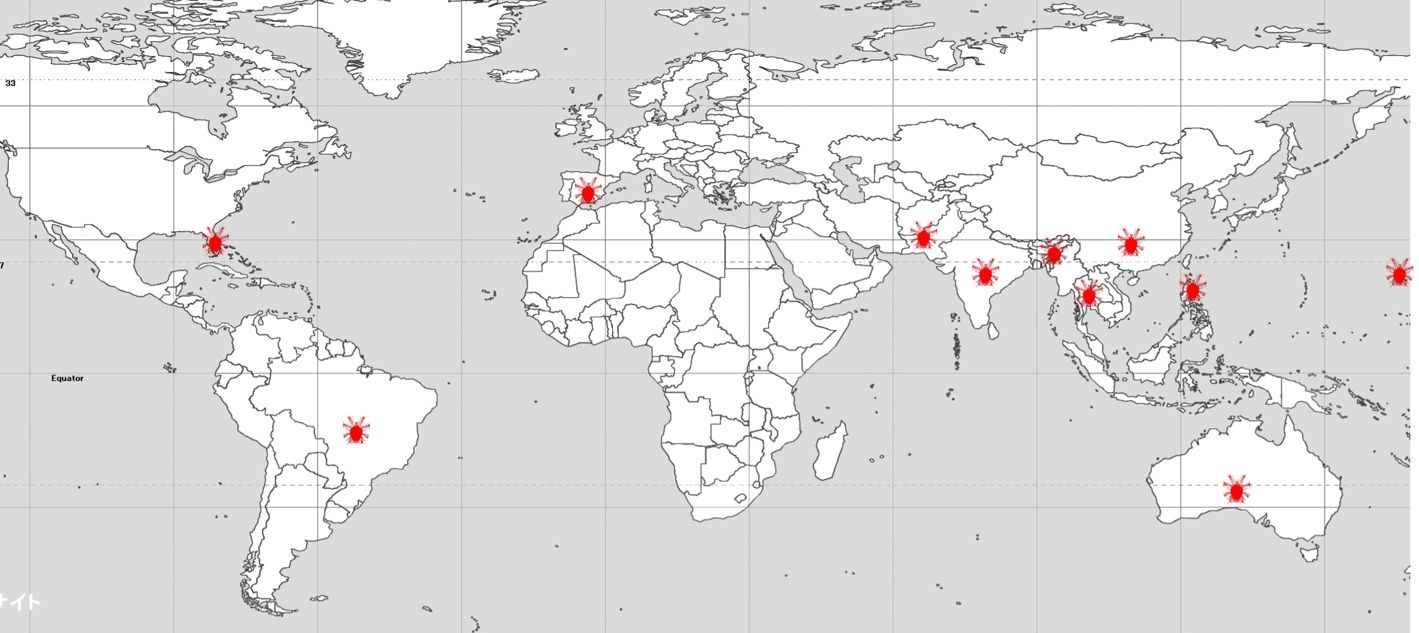
El ácaro de la erinosis del lichi, Aceria litchii (Keifer) (Acari: Eriophyidae), es una de las plagas más importantes del lichi (Litchi chinensis Sonn., Sapindaceae). Este ácaro eriófido es una plaga nativa de Asia y ha sido reportada en India (Sharma 1985), Pakistán (Alam y Wadud 1963), Bangladesh (Haque et al. 1998), Tailandia (Keifer y Knorr 1978), China y Taiwán (Huang 1967), Hawái (Keifer 1943), y Australia (Pinese 1981) (Figura 1). Más recientemente el LEM fue encontrado en Brasil (Raga et al. 2010; Fornazier et al. 2014), donde se ha dispersado hacia las áreas de mayor producción de lichi, causando pérdidas estimadas en un 70-80 % de reducción en el rendimiento e incrementado los costos de producción en un 20% (Navia et al. 2013). Prasad y Singh (1981) a su vez reportaron un 80% de reducción en rendimiento en India a causa del LEM. En febrero del 2018, el LEM fue encontrado en el condado de Lee, Florida, y desde ese momento se ha expandido a varios condados en el centro y sur de Florida (Carillo et al. 2020). Como resultado de esta incursión, la División de Industria Vegetal del Departamento de Agricultura y Servicios al Consumidor del estado de Florida (FDACS-DPI, por sus siglas en inglés) estableció un programa de erradicación y cuarentena en el condado de Lee, programa que actualmente ha sido suspendido.
Créditos: Indefinidos
Sinonimia
Eriophyes litchii Keifer (1943)
Identificación, síntomas del daño y rango de hospederos
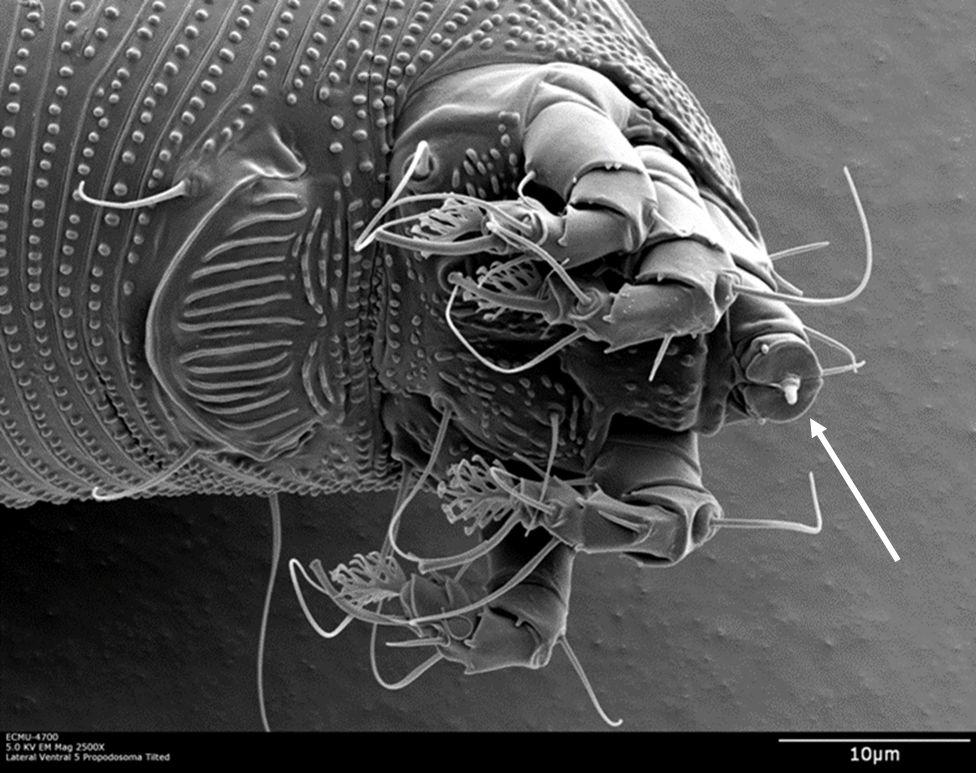
Como un caso típico de los ácaros eriófidos, el LEM es vermiforme (forma tubular) y tiene dos pares de patas. Tiene 150 µm de longitud aproximadamente y no se puede ver a simple vista (Figura 2).

Créditos: Dr. G. Bauchan†, SEL-USDA
El LEM usa una serie de estiletes (Figura 3) para perforar y alimentarse de las células epidérmicas de la hoja. Las células afectadas usualmente mueren, pero las células epidérmicas en los alrededores desarrollan alteraciones morfológicas (cambios estructurales), que resultan en alargamiento (hiperplasia) de las setas de las hojas (tricomas), referidas como “erinosis” (Karioti et al. 2011). El agrandamiento y profusión excesiva de ramas en estos tricomas de las hojas proveen un ambiente favorable a los ácaros, protegiéndolos de enemigos naturales y de adversidades ambientales.
Créditos: Dr. G. Bauchan†, SEL-USDA
La erinosis se desarrolla inicialmente en la cara inferior de las hojas (envés), presentando un color entre blanco y transparente y causando deformación y curvado de las hojas (Figura 4a). Sin embargo, en este estado de la infestación el cambio de coloración puede ser visible en la cara superior de las hojas (haz) (Figura 4b). A medida que las poblaciones del LEM aumentan, la erinosis cambia de color, grosor y densidad. Una erinosis que es densa y blanca (Figura 4c) tiene menos ácaros en comparación con una de color ámbar (Figura 4d). Las erinosis de color café oscuro o negro (Figura 4e) tienen pocos e incluso ningún ácaro. En este último estado los ácaros han sobrexplotado la hoja y se dispersan en busca de nuevos brotes dentro de la misma planta. La erinosis también se puede desarrollar en peciolos, tallos, panículas, botones florales y frutos, y puede variar en tamaño, forma y color (Figura 5). Infestaciones severas generalmente presentan múltiples erinosis de mayor tamaño, que varían en maduración debido al tiempo que les toma a los ácaros dispersarse en la planta (Nishida y Holdaway 1955; Sabelis y Bruin 1996). El mecanismo exacto que explica la formación de la erinosis todavía es desconocido. Investigaciones que actualmente se llevan a cabo en el Tropical Research and Education Center (UF/ IFAS TREC) buscan entender la interacciones entre estos ácaros y las plantas e investigar cómo se forma la erinosis.

Créditos: Alexandra M. Revynthi, UF/IFAS TREC

Créditos: Alexandra M. Revynthi y Daniel Carrillo, UF/IFAS TREC, Amy Roda, USDA-APHIS
El ácaro de la erinosis del lichi es altamente específico con respecto a su hospedante y está bien documentado como plaga del lichi (Oldfield 1996). Existe solo un reporte de LEM atacando longuián (Dimocarpus longan) en Taiwán (Huang 2008); sin embargo, esto es posiblemente una anomalía. El autor pudo haber confundido LEM con un ácaro cercanamente relacionado, Aceria dimocarpi (Kuang), que ataca el longuián, o el ácaro fue interceptado en el longuián, pero sin causar algún daño. En Brasil y Florida, los árboles de longuián sembrados a la par con árboles de lichi infestados con LEM nunca desarrollaron algún síntoma. Los árboles jóvenes de lichi son más susceptibles al ataque del LEM, y algunas variedades de lichi pueden ser más susceptibles que otras (Arantes et al. 2017). Sin embargo, todas las variedades de lichi sembradas en Florida han mostrado susceptibilidad al LEM.
Ciclo de vida y dispersión
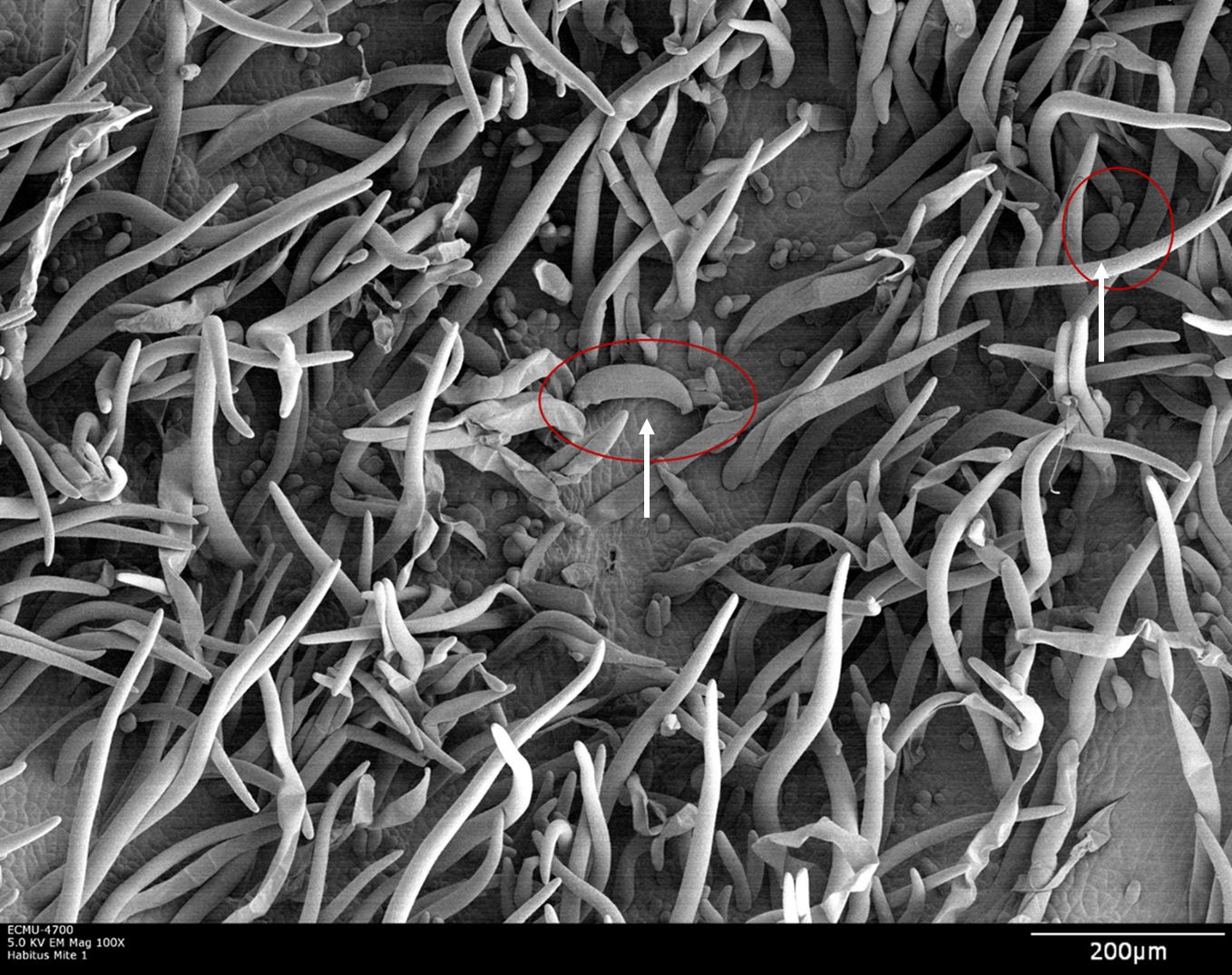
Los huevos del LEM solo son depositados luego de la formación de la erinosis y son localizados en la base de ésta (Figura 6). Los huevos tienen aproximadamente 32 µm en longitud y eclosionan en un rango de entre tres y cuatro días. Las larvas son de 49 µm de longitud en promedio, y mudan al estado de ninfa luego de dos a tres días. Las ninfas del LEM son en promedio de 80 µm de longitud y mudan al estado adulto luego de cinco a siete días (Alam y Wadud 1963). El desarrollo desde el huevo hasta el adulto toma aproximadamente 14 días dependiendo de las condiciones ambientales (Jeppson et al. 1975). Múltiples temporadas de reproducción ocasionan generaciones superpuestas sobre el transcurso de un año. El crecimiento poblacional es favorecido por nuevos brotes en los árboles durante periodos secos y moderadamente calientes. Alta temperatura, alta humedad relativa y alta pluviosidad resultaron desfavorables para el LEM en Pakistán (Alam y Wadud 1963), pero en Brasil no se encontró correlación entre las poblaciones del LEM y estos factores ambientales (Azevedo et al. 2014).
Créditos: Dr. G. Bauchan, SEL-USDA
Los ácaros prefieren alimentarse de nuevos brotes, los cuales infestan caminando de una hoja a la otra (Alam y Wadud 1963; Azevedo et al. 2013) (Figura 4). En dispersiones de amplio rango, el LEM utiliza la foresis, adhiriéndose a los cuerpos de abejas durante el periodo de floración (Waite y McAlpine 1992; Waite 1999). Los ácaros también se pueden dispersar mediante corrientes de aire o mediante tejido vegetal a partir de material de propagación a través de acodos aéreos. Los acodos aéreos son un método de propagación de nuevos árboles a partir de nuevas ramas todavía conectadas al árbol parental. El transporte de acodos aéreos producidos de un árbol parental infestado con LEM facilita el movimiento de los ácaros a nuevos sitios.
Manejo
El monitoreo frecuente y regular de las plantas debe ser implementado para una detección temprana de las infestaciones de LEM. Cualquier nuevo brote que esté emitiendo tallos y hojas/o panículas es especialmente susceptible al ataque del LEM. El monitoreo de la presencia de LEM requiere de inspecciones regulares y frecuentes del follaje para detectar los síntomas, especialmente alrededor del tiempo cuando se espera que los árboles presenten nuevo crecimiento o cuando están en la formación activa de nuevos brotes. Estos ácaros no pueden ser vistos con lupas de mano; se requiere de alta magnificación (estereomicroscopio).
El control químico en combinación con podas son la principal alternativa que se utiliza mundialmente para el manejo de las infestaciones de LEM. Varios ingredientes activos han mostrado algo de eficacia (Schulte et al. 2007; Azevedo et al. 2013), pero un control satisfactorio solo se alcanza mediante tratamientos que ofrezcan protección al nuevo crecimiento de forma oportuna y precisa (Waite 2005; Picoli et al. 2010). En otras regiones con presencia del LEM, se realizan aplicaciones foliares con varios acaricidas (Castro et al. 2018; Nadhida y Holdway 1955; Schulte et al. 2007; Waite 2005). Sin embargo, muchos de estos productos no están aprobados para su uso en los Estados Unidos. Todos estos acaricidas son profilácticos (aplicados antes de la infestación del LEM) y no actúan sobre el LEM una vez que la erinosis se ha establecido.
Recientemente, solo dos acaricidas, bifenazato y abamectina, fueron registrados para su uso en lichi en Florida. El bifenazato es un acaricida usado en varias especies de arañas rojas, pero no es conocido por ser activo en ácaros de las agallas, arañas blancas o sobre ácaros planos (Cloyd 2004). La abamectina es usada en un amplio espectro de especies de ácaros, incluyendo múltiples especies de ácaros de las agallas como el ácaro rojizo del tomate (Aculops lycopersici) y el ácaro del brote de los cítricos (Aceria sheldoni). Este acaricida, sin embargo, solo puede ser aplicado dos veces por año en el lichi y no es compatible con azufre. En los primeros meses de 2021, la Agencia de Protección Ambiental de los Estados Unidos (EPA por sus siglas en inglés) puso a disposición una Etiqueta para Necesidades Locales Especiales (Registro EPA: 70506-187), que fue aprobada por el FDACS-DPI, para el uso de azufre (Microthiol Disperss®, UPL, King of Prussia, PA, USA) para el control del LEM en lichi.
La principal estrategia de control cultural en contra del LEM consiste en la remoción y quema de ramas infestadas (Waite 2005; Castro et al. 2018). La poda debe ser seguida por aplicaciones de azufre para proteger los nuevos brotes (ver abajo). Las podas sin la aplicación suplementaria de azufre pueden agravar la dispersión del LEM. Las prácticas culturales se combinan con la aplicación repetida de azufre para prevenir la colonización de nuevos brotes y hojas por el LEM. Una vez que los árboles son podados, se hace una aplicación de Microthiol Disperss®. El azufre es aplicado hasta que escurra a todas las partes de las plantas, incluyendo el tronco. Una vez que empiezan a emerger nuevos brotes, las aplicaciones de azufre se deben realizar cada 15 días hasta que las hojas se endurezcan y el árbol cese en su producción de nuevos brotes. Los ensayos de fitotoxicidad realizados en el TREC han mostrado muy poca a nula fitotoxicidad de las aplicaciones de azufre. Sin embargo, durante periodos de altas temperaturas el azufre puede quemar el follaje y los frutos. Se deben evitar aplicaciones de azufre con temperaturas por encima de 90°F por tres días consecutivos. Adicionalmente, los productos a base de azufre no son compatibles con aplicaciones de aceites.
La cosecha de lichi implica la poda de racimos cargados de fruta. Luego de la cosecha, se recomienda la poda de los árboles. Los propósitos de esta poda postcosecha es manejar el tamaño del árbol, mantener la exposición al sol del dosel, buscar la producción de fruta en todos los lados del árbol, sincronizar el brote y el desarrollo de ramas, hacer prácticas culturales como el control de plagas foliares y una eficiente fertilización y reducir el potencial de daño mecánico por tormentas tropicales y huracanes. Nótese que las podas postcosecha sin aplicación de azufre pueden agravar la dispersión del LEM.
De acuerdo con las regulaciones actuales, los productores de lichi en locaciones donde el LEM ha sido detectado pueden empacar fruta a otros estados no productores de lichi, pero no están autorizados para vender esta fruta en el estado de Florida. En respuesta a estas limitaciones, Revynthi et al. (2020) desarrollaron un tratamiento postcosecha usando inmersiones en aceite parafínico que puede ser usado para desinfestar del LEM las frutas de lichi. Este tratamiento no afecta la calidad de la fruta. El FDACS-DPI ha aprobado este tratamiento postcosecha que va a permitir a productores en el condado de Lee y otras áreas en cuarentena vender fruta en el estado de Florida.
Varios enemigos naturales han sido reportados asociados al LEM en India (Lall y Rahman, 1975; Thakur y Sharma 1990), Australia (Schicha 1987; Waite y Gerson 1994), Brasil (Picoli et al. 2010; Azevedo et al. 2014) y China (Waite y Hwang 2002). Sin embargo, la depredación sobre el LEM solo ha sido confirmada para unas pocas especies de ácaros depredadores, incluyendo Amblyseius largoensis (Muma) (Acari: Phytoseiidae) en China (Cheng et al. 2015) y Phytoseius intermedius Evans & MacFarlane (Acari: Phytoseiidae) en Brasil (Evans y Macfarlane 1961; Azevedo et al. 2014). Phytoseius intermedius ha sido el depredador más frecuentemente asociado con el LEM, y estudios detallados determinaron que el LEM es una presa adecuada para este depredador (Azevedo et al. 2014). Sin embargo, a pesar de la frecuencia de ocurrencia de P. intermedius, no fue posible determinar que su presencia detuviera el daño en los árboles (Azevedo et al. 2014). Picoli y Vieira (2013), quienes reportaron al hongo entomopatógeno Hirsutella thompsonii (Fischer) parasitando de forma natural al LEM en Brasil, sugieren que la erinosis puede facilitar el desarrollo y persistencia del hongo en las plantas. Tres ácaros depredadores fitoseidos han sido encontrados asociados con el LEM en Florida, Phytoseius woodburyi De Leon, Amblyseius largoensis y Euseius mesembrinus (Dean) (Acari: Phytoseiidae). Sin embargo, su potencial como agentes de control biológico del LEM no ha sido evaluado.
Si usted sospecha que tiene una infestación del LEM por favor contacte al FDACS-DPI (tel: 1-888-397-1517) y su agente de Extensión local de UF/IFAS para más información. Además, para información más actualizada visite el sitio web de UF/IFAS Tropical Research and Education Center dedicado al ácaro de la erinosis del lichi (https://trec. ifas.ufl.edu/Lychee-Erinose-Mite/)
Referencias
Alam, Z.M. and Wadud MA (1963) On the biology of Litchi mite, Aceria litchi Keifer (Eriophyidae, Acarina) in East Pakistan. Pak J Sci 15:232-240.
Arantes, R.F., de Andrade, D.J., Amaral I. MABG (2017) Evaluation of Litchi varieties seeking sources resistant to Aceria litchi mite. Rev Bras Frutic 39:1-7. https://doi.org/10.1590/0100-29452017816
Azevedo LH, Moraes GJ, Yamamoto PT, Zanardi OZ (2013) Development of a methodology and evaluation of pesticides against Aceria litchii and its predator Phytoseius intermedius (Acari: Eriphyidae, Phytoseiidae). J Econ Entomol 106:2183-2189. https://doi.org/10.1603/EC13026
Azevedo LH, Maeda EY, Inomoto MM, De Moraes GJ (2014) A Method to estimate the population level of Aceria litchii (Prostigmata: Eriophyidae) and a study of the population dynamics of this species and its predators on litchi trees in southern Brazil. J Econ Entomol 107:361-367. https://doi.org/10.1603/EC13337
Bolton SJ, Klompen H, Bauchan GR, Ochoa R (2014) A new genus and species of Nematalycidae (Acari: Endeostigmata). J Nat Hist 48:1359-1373. https://doi.org/10.1080/00222933.2013.859318
Carrillo D, Cruz LF, Revynthi AM, Duncan RE, Bauchan GR, Ochoa R, Kendra PE, Bolton SJ. (2020) Detection of the Lychee Erinose Mite, Aceria litchii (Keifer) (Acari: Eriophyidae) in Florida, USA: A Comparison with Other Alien Populations. Insects 11:235. https://doi.org/10.3390/insects11040235
Castro BMC, Plata-Rueda A, Meloni Silva W, Guimarães de Menezes CW, Wilcken CF, Zanuncio JC (2018) Manejo del ácaro Aceria litchii (Acari: Eriophyidae) en Litchi chinensis. Rev Colomb Entomol 44:2. https://doi.org/10.25100/socolen.v44i1.6528
Cheng L, Zhang X, Sha L, Lu A, Chen P (2005) Functional and numerical response of Amblyseius largoensis to Aceria litchii. Chinese Journal of Tropical Crops 8: 52-59.
Cloyd RA (2004) All Miticides Are Not Created Equal. Home, yard and garden pest Newsletter. Issue No. 17. University of Illinois Extension.
Evans GO, Macfarlane D (1961) A new mite of the genus Phytoseius Ribaga (Acari : Mesostigmata). Ann Mag Nat Hist 4:587-588. https://doi.org/10.1080/00222936108651183
Fornazier MJ, Martins DDS, Fornazier DL, Azevedo LH, Jr JSZ, Zanuncio JC (2014) Range Expansion of the Litchi Erinose Mite Aceria Litchii (Acari: Eriophyidae) in Brazil. Florida Entomol 97:846-848. https://doi.org/10.1653/024.097.0276
Haque MM, Das BC, Khalequzzaman M, Chakrabarti S (1998) Eriophyoid mites (Acari: Eriophyoidea) from Bangladesh. Orient Insects 32:35-40. https://doi.org/10.1080/00305316.1998.10433765
Huang, K. 2008. Aceria (Acarina: Eriophyoidea) in Taiwan: five new species and plant abnormalities caused by sixteen species. Zootaxa 1829: 1-30. https://doi.org/10.11646/zootaxa.1829.1.1
Huang, T. 1967. A study on morphological features of erinose mite of litchi (Eriophyes litchii Keifer) and an observation on the conditions of its damage. Plant Protection Bulletin 9: 35-46.
Jeppson LR, Keifer HH, Baker EW. (1975). Mites Injurious to Economic Plants. University of California Press. https://doi.org/10.1525/9780520335431
Karioti A, Tooulakou G, Bilia AR, et al. (2011). Erinea formation on Quercus ilex leaves: Anatomical, physiological and chemical responses of leaf trichomes against mite attack. Phytochemistry 72:230-237. https://doi.org/10.1016/j.phytochem.2010.11.005
Keifer HH (1943) Eriophyid studies XIII. State Calif Dep Agric Bull 32:212-222. https://doi.org/10.2217/fon.11.36
Keifer, H.H. and Knorr, L.C. (1978) Eriophyid mites of Thailand. Plant Protection Service Technical Bulletin 38, Bangkok, pp. 1-36
Lall, B.S. and Rahman, M.F. (1975) Studies on the bionomics and control of the erinose mite Eriophyes litchii Keifer (Acarina: Eriophyidae). Pesticides 9, 49-54.
Navia D, Júnior ALM, Gondim Jr. MGC, et al (2013) Recent mite invasions in South America. Potential Invasive Pests Agric Crop 251-287. https://doi.org/10.1079/9781845938291.0251
Nishida, T. and Holdaway, F.G. (1955) The erinose mite of lychee. Circular No. 48, Hawaii Agriculture Experiment Station, Honolulu, Hawaii, pp. 10.
Oldfield, GN (1996) Diversity and host plant specificity. In: Lindquist, EE, Sabelis, MW and Bruin, J (eds) Eriophyoid Mites - Their Biology, Natural Enemies and Control. World Crop Pests vol 6. Elsevier Science Publishing, Amsterdam, pp. 199-216. https://doi.org/10.1016/S1572-4379(96)80011-X
Picoli PRF, Vieira MR (2013) Primeiro relato de atividade patogênica de Hirsutella thompsonii (Fischer) sobre o ácaro-da-erinose-da-lichia Aceria litchii (Keifer). Semin Agrar 34:187-190. https://doi.org/10.5433/1679-0359.2013v34n1p187
Picoli PRF, Vieira MR, da Silva EA, da Mota MS de O (2010) Ácaros predadores associados ao acaro-da-erinose da lichia. Pesqui Agropecu Bras 45:1246-1252. https://doi.org/10.1590/S0100-204X2010001100003
Pinese B (1981) Erinose mite - a serious litchi pest. Queensl Agric Journal 107:79-81.
Raga A, Mineiro JL de C, Sato ME, et al (2010) Primeiro relato de Aceria litchii (Keifer) (prostigmata: eriophyidae) em plantas de lichia no Brasil. Rev Bras Frutic 32:628-629. https://doi.org/10.1590/S0100-29452010005000046
Revynthi AM, Duncan RE, Mannion C, Kendra PE, Carrillo D (2020) Post-Harvest Paraffinic Oil Dips to Disinfest Lychee Fruit of Lychee Erinose Mite. Florida Entomol 103:299-301. https://doi.org/10.1653/024.103.0224
Sabelis, M.W. and Bruin, J (1996) Evolutionary ecology: life history patterns, food plant choice and dispersal. In: Lindquist, E.E., Sabelis, M.W. and Bruin, J. (eds) Eriophyoid mites - their biology, natural Enemies and control. Elsevier Science Publishing, Amsterdam, The Netherlands, pp. 329-366. https://doi.org/10.1016/S1572-4379(96)80020-0
Schicha E (1987) Phytoseiidae of Australia and neighboring areas. Indira Pub. House
Schulte MJ, Martin K, Sauerborn J (2007) Efficacy of spiromesifen on Aceria litchii (Keifer) in relation to Cephateuros virescens Kunze colonization on leaves of litchi (Litchi chinensis Sonn.). J Plant Dis Prot 114:133-137. https://doi.org/10.1007/BF03356721
Thakur, A.P. and Sharma DD (1990) Influence of weather factors and predators on the populations of Aceria litchii Keifer. Indian J Plant Prot 18:109-112.
Waite GK (1999) New evidence further incriminates honey-bees as vectors of lychee erinose mite Aceria litchii (Acari: Eriophyiidae). Exp Appl Acarol 23:145-147. https://doi.org/10.1023/A:1006002611074
Waite GK (2005) Pests. In: Litchi and Longan: Botany, production and uses (eds C.M. Menzel and G.K. Waite). pp 237-259. https://doi.org/10.1079/9780851996967.0237
Waite GK, Gerson U (1994) The predator guild associated with Aceria litchii (Acari: Eriophyidae) in Australia and China. Entomophaga 39:275-280. https://doi.org/10.1007/BF02373032
Waite GK, McAlpine JD (1992) Honey bees as carriers of lychee erinose mite Eriophyes litchii (Acari: Eriophyiidae). Exp Appl Ácarol 15:299-302. https://doi.org/10.1007/BF01246570
Waite GK, Hwang JS (2002) Pests of litchi and longan In Pena JE, Sharp JL, Wysoki M (eds) Tropical fruit pests and pollinators: biology, economic importance, natural enemies and control. CAB International, Wallingford, UK, pp 331-359. https://doi.org/10.1079/9780851994345.0331