Introducción
El propósito de este documento es proveer información general del estado actual del conocimiento sobre el caracol cola de cuerno (Macrochlamys indica Benson), así como dar recomendaciones para su detección y monitoreo en los viveros.
El caracol cola de cuerno fue detectado en agosto del 2020 en el condado de Miami-Dade (Talamas 2020). Este caracol se considera una plaga de importancia que justifica cuarentena en los Estados Unidos debido a que se puede convertir en una plaga agrícola y es potencialmente hospedero de nematodos parásitos de importancia médica (Grewal et al. 2003; Cowie et al. 2009; Jayashankar y Murthy 2015). Un programa de monitoreo, control y erradicación del caracol cola de cuerno fue implementado por la División de Industria Vegetal del Departamento de Agricultura y Servicios al Consumidor del estado de Florida (FDACS-DPI, por sus siglas en inglés). En la actualidad el programa de erradicación ha sido suspendido por parte de FDACS-DPI.
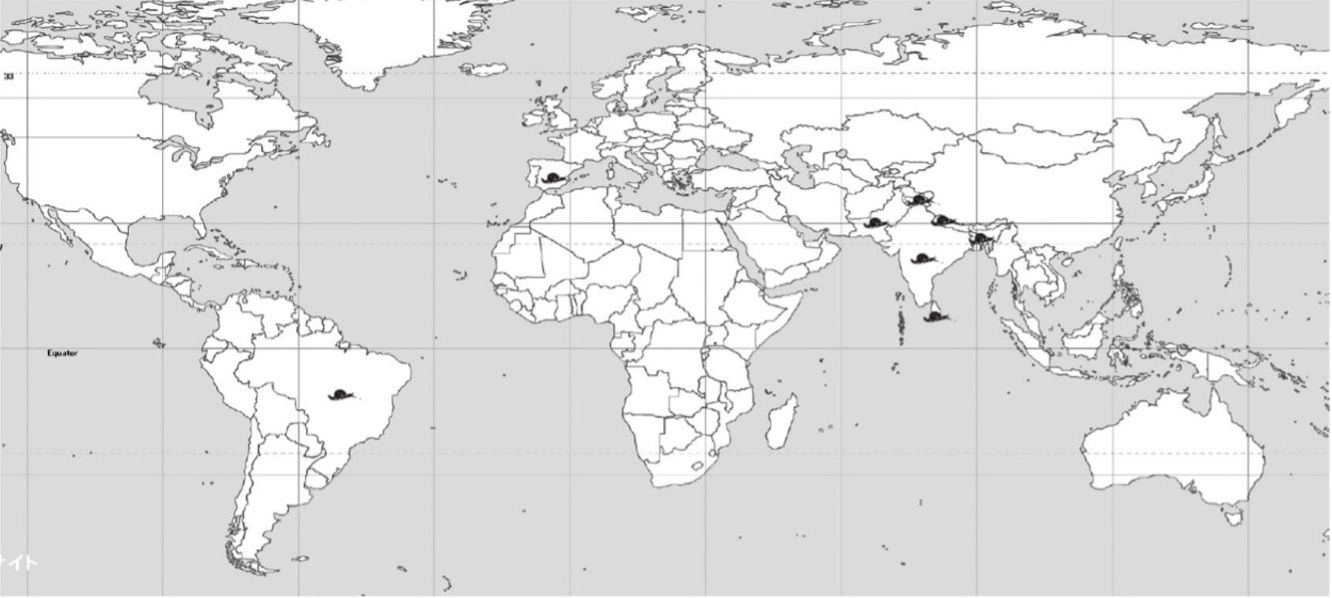
El caracol cola de cuerno pertenece al género Macrochlamys (Family Ariophantidae), que tiene más de cien especies descritas desde Suramérica hasta el sureste de Asia y sur de China (Pholyotha et al. 2018). Esta plaga está reportada en India, Sri Lanka, Bangladesh, Pakistán y Brasil (Figura 1) (Raut y Ghose 1984; Biswas et al. 2015; Jayashankar et al. 2015; Agudo-Padron 2018). Jayasshankar et al. (2015) reportaron su presencia en Europa; sin embargo, sin especificar su ubicación y sin poner a disposición información adicional que soporte este reporte. En Bangalore, India, se le conoce comúnmente como el caracol del jardín, teniendo poblaciones más altas en ambientes urbanos que en áreas agrícolas (Jayasshankar et al. 2015).
Identificación
El caracol cola de cuerno tiene un manto de color café, mientras que la concha es de color ámbar (Figura 2). En la punta de su cola, M. indica tiene una protuberancia en forma de cuerno, de la cual se deriva su nombre común (Talamas 2020). El tamaño de los caracoles adultos varía con la edad y el diámetro de la concha puede estar en un rango entre 10 a 21 mm (0,39 – 0,83 in) (Raut y Ghose 1984) (Tabla 1). Una característica de esta especie es la extensión de tejido del manto que se proyecta hacia atrás o alrededor de la concha (para ilustraciones, ver Talamas 2020). En Florida, el caracol saltador (Ovachlamys fulgens (Gude)) tiene características similares, como una cola posterior o colores semejantes de manto y concha. Sin embargo, este caracol tiene un cuerpo más delgado y alargado, siendo además su cuerno posterior más grande y grueso (para descripción y figuras, ver Salles et al. 2018).

Créditos: FDACS-DPI
Rango de hospederos y daño
La información acerca del caracol cola de cuerno con relación a su estatus como plaga agrícola y como vector en su área de origen es escasa. Se alimenta de plántulas y hojas caídas en descomposición (Raut y Ghose 1983, 1984; Jayashankar et al. 2015). Se le considera una plaga menor en algunas localidades en India, donde se alimenta casi exclusivamente de musgo que crece en paredes de ladrillo donde se acumula humedad (Jayashankar et al. 2015). En todo caso, el caracol cola de cuerno puede alimentarse de diferentes tipos de plantas, incluyendo hortalizas, frutales y ornamentales. En estudios con plantas individualizadas en jaulas, las hortalizas preferidas incluyeron cucurbitáceas, frijoles, lechuga, okra y repollo; mientras que la planta de papaya fue el árbol frutal preferido. Las ornamentales como crisantemo, hibisco, flor de muerto y rosal fueron a su vez las especies mas preferidas en este tipo de estudios (Raut y Ghose 1983, 1984). En general, los caracoles jóvenes se alimentan de tejidos tiernos y evitan los peciolos y las nervaduras de las hojas, mientras que los adultos consumen cualquier parte de la planta (Raut y Ghose 1983).
Biología
La biología del caracol cola de cuerno fue estudiada bajo condiciones de campo y laboratorio en Bangalore, India. La humedad relativa fue hallada como el factor más importante con respecto a la dinámica poblacional de la especie (Raut y Ghose 1979, 1984). Cuando la humedad relativa en el entorno es inferior al 46%, el caracol entra en un estado de dormancia denominado estivación. La estivación varia con respecto a la latitud geográfica y puede fluctuar desde dos a ocho meses. Durante ese periodo, los caracoles permanecen escondidos e inactivos, mientras pierden algo de peso (Raut y Ghose 1979, 1984). En el sur de la India, el caracol tiene un periodo de estivación de ocho meses y permanece activo durante la temporada de monzones. Un solo individuo puede vivir hasta cuatro años, mientras los caracoles jóvenes requieren 130 días para alcanzar la madurez reproductiva. Las condiciones óptimas para el apareamiento fluctúan con temperaturas entre 21°C y 30°C (69,8°F y 86°F) y humedades mayores a 86%. El apareamiento usualmente ocurre luego de las lluvias, mientras que el periodo de gestación presenta un rango de duración de entre 10 y 17 días.
Tabla 1. En India, en condiciones de campo, los caracoles cola de cuerno (Macrochlamys indica Benson) de diferentes edades varían en tamaño y tasa de oviposición (Raut y Ghose 1984).
En la India, la oviposición comienza cuando los caracoles están en su segundo año (Tabla 1). Los huevos son depositados en grupos bajo suelo suelto. Los caracoles adultos necesitan aproximadamente de 10 a 24 minutos para depositar un grupo de huevos y, en promedio, permanecen en el nido por 11 minutos luego de la oviposición (Raut y Ghose 1984). Los huevos son redondeados, translúcidos y con un tamaño entre 3,0 a 3,5 mm (0,12 a 0,14 pulgadas). El número de posturas y de huevos por postura varía con la edad de la hembra (ver Tabla 1). Las posturas son depositadas a intervalos de 12 a 49 días, y el periodo de incubación presenta un rango desde ocho hasta 12 días. Luego de la eclosión, los caracoles jóvenes permanecen inmóviles durante 14 a 20 horas, y luego comienzan a alimentarse en el cuarto o quinto día (Raut y Ghose 1984). Sin embargo, es posible que el caracol no presente los mismos hábitos de reproducción y alimentación en las nuevas áreas de invasión.
Bajo condiciones de laboratorio con temperaturas entre 21°C y 30°C (69,8°F y 86°F) y humedad relativa constante del 90%, el ciclo de vida del caracol fluctuó desde 15 hasta 19 meses, sin manifestaciones de estivación. Los caracoles colocaron hasta cinco posturas por año con un promedio de 16 huevos por postura. Bajo estas condiciones los caracoles jóvenes requirieron de diez meses para alcanzar la madurez reproductiva (Sudhakar 2013).
Dispersión y ecología
Como otros caracoles, el caracol cola de cuerno no se dispersa largas distancias de forma natural. La actividad humana mediante el transporte de plantas y materiales ornamentales representa el mecanismo más importante para su llegada a nuevas áreas (Bergey et al. 2014). La reducida capacidad de desplazarse largas distancias a su vez ofrece la oportunidad de erradicar poblaciones locales (Roda et al. 2016). Como en la mayoría de los caracoles, la dispersión activa ocurre en las noches y en días lluviosos o nublados (Bailey 1981).
La humedad relativa es el factor más crítico con respecto a la biología y el comportamiento del caracol cola de cuerno. Las condiciones ambientales óptimas para su desarrollo fluctúan en temperaturas entre 28°C y 31°C (82,4°F y 87,8°F), con una mínima de 19°C (66,2°F) y una humedad relativa entre 85 y 100%. Incluso si la temperatura fluctúa entre 9°C a 43°C (48,2°F y 109,4°F), el caracol puede permanecer activo siempre y cuando la humedad relativa esté por encima del 60% (Raut y Ghose 1984).
Asociación con patógenos humanos
La asociación del caracol cola de cuerno y nematodos de importancia médica no ha sido estudiada en detalle. Un solo estudio menciona una asociación con una especie no parásita de nematodo del género Rhabditis al oeste de Bengal, India (Cowie et al. 2009; Jayashankar y Murthy 2015). Sin embargo, especies cercanas como Macrochlamys resplendens y el caracol gigante africano (Achatina fulica), son hospederos de los nematodos del género Angiostrongylus, que causan la meningoencefalitis eosinofílica en humanos (Grewal et al. 2003). De acuerdo con lo anterior, no se puede descartar la posibilidad de que el caracol cola de cuerno pueda hospedar nematodos de importancia médica.
Recomendaciones para optimizar la detección y el monitoreo de las poblaciones del caracol cola de cuerno
La detección temprana y el monitoreo del caracol cola de cuerno en el campo son cruciales para el éxito en su control/erradicación. Las recomendaciones para optimizar la detección del caracol incluyen:
- Busque los caracoles en la noche cuando están más activos, especialmente luego de eventos de lluvia. Recuerde que además del caracol cola de cuerno ya existen otros caracoles en nuestro ambiente. La identificación apropiada es clave para un programa de manejo exitoso. El FDCAS-DPI puede asistirlo con la identificación del caracol.
- Durante las horas del día, los caracoles se pueden buscar por los rastros que dejan al desplazarse y los daños en las plantas.
- Busque los caracoles en pilas de residuos, ladrillos, grietas en las paredes y cerca de plántulas o plantas suculentas.
- Busque los caracoles en áreas que permanezcan mojadas o húmedas, como cerca de unidades de aire acondicionado, sistemas de bombeo de riego y bajo coberturas.
- Capacite al personal que esté trabajando en la producción de plantas ornamentales, hortalizas y frutas tropicales en el monitoreo de las poblaciones del caracol.
Adicionalmente, las siguientes acciones pueden ser tomadas en cuenta para reducir las poblaciones del caracol:
- Realice labores de saneamiento removiendo áreas de refugio como tablas, piedras, residuos, áreas de barbecho, ramas con abundancia de hojas creciendo cerca del suelo, coberturas densas en el suelo y todas aquellas áreas que puedan conservar humedad.
- En lo posible, permita un ambiente lo menos húmedo posible mediante el ajuste del riego en su frecuencia e intensidad, reparando lo más pronto posible fugas en el sistema y mejorando el drenaje.
Si usted encuentra el caracol cola de cuerno en su propiedad contacte su oficina de Extensión de UF/IFAS del condado local (ver http://sfyl.ifas.ufl.edu/find-your-local-office/) y al Departamento de Agricultura y Servicios al Consumidor del estado de Florida (FDACS-DPI). Para más información de la línea de apoyo de DPI, consulte: https://www.fdacs.gov/Agriculture-Industry/Pests-and-Diseases/Plant-Pests-and-Diseases/Invasive-Mollusks, llame al 1-888-397-1517 o envíe fotos a la dirección DPIhelpline@FDACS.gov. Aquellos sitios donde el caracol cola de cuerno sea detectado serán requeridos con la retención de órdenes de entrega, con la permanencia en cuarentena por al menos 30 días, con la firma de un acuerdo de cumplimiento y con el seguimiento de un protocolo de tratamiento con metaldehído (> 3,25%) de acuerdo con las recomendaciones de FDACS. Para más información, vaya al documento actual de FDACS sobre alerta de plagas: https://www.fdacs.gov/content/download/93400/file/horntail-snail-pest-alert.pdf. Los molusquicidas con metaldehído (> 3,25%) registrados para su uso en viveros y cultivos de plantas ornamentales pueden ser encontrados en la Tabla 2. Nota: no toque los caracoles con las manos directamente. Se recomienda el uso de guantes para la manipulación de los caracoles.
Tabla 2. Molusquicidas registrados en Florida para uso en viveros y en cultivos ornamentales. Los productos contienen más de 3,25% de metaldehído, el mínimo porcentaje recomendado por FDACS para la erradicación del caracol cola de cuerno (Macrochlamys indica Benson).
Referencias
Agudo-Padron (2018) Revised and updated systematic inventory of non-marine molluscs occurring in the State of Santa Catarina/S.C., Central Southern Brazil region. Adv Environ Stud 2:74–81. https://doi.org/10.36959/742/202
Bailey SER (1981) Circannual and circadian rhythms in the snail Helix aspersa Müller and the photoperiodic control of annual activity and reproduction. J Comp Physiol 142:89–94. https://doi.org/10.1007/BF00605480
Bergey EA, Figueroa LL, Mather CM, et al (2014) Trading in snails: Plant nurseries as transport hubs for non-native species. Biol Invasions 16:1441–1451. https://doi.org/10.1007/s10530-013-0581-1
Biswas T, Tripathy B, Valarmathi K, Sajan SK (2015) Taxonomy, distribution and conservation of Molluscs in Kangra District of Himachal Pradesh: Three new records from the State. Ambient Sci 2:18–24. https://doi.org/10.21276/ambi.2015.02.2.ra02
Cowie RH, Dillon RT, Robinson DG, Smith JW (2009) Alien non-marine snails and slugs of priority quarantine importance in the United States: A preliminary risk assessment. Am Malacol Bull 27:113–132. https://doi.org/10.4003/006.027.0210
Grewal PS, Grewal SK, Tan L, Adams BJ (2003) Parasitism of molluscs by nematodes: Types of associations and evolutionary trends. J Nematol 35:146-156
Jayashankar M, Murthy GSS (2015) Record of gut associated nemathelminth in the giant African snail Achatina fulica (Bowdich) from Bangalore, India. J Parasit Dis 39:144–146. https://doi.org/10.1007/s12639-013-0303-8
Jayashankar M, Reddy MS, Ramakrishna S (2015) Incidence of the Common Garden Snail, Macrochlamys indica Benson, 1832 (Gastropoda: Ariophantidae) in Bangalore Region. N Save Nat to Surviv 10:1003–1006
Pholyotha A, Sutcharit C, Panha S (2018) The land snail genus Macrochlamys Gray, 1847 from Thailand, with descriptions of five new species (Pulmonata: Ariophantidae). Raffles Bull Zool 7600:763-781
Raut SK, Ghose KC (1984) Pestiferous land snails of India. Zool Surv India 1–151
Raut SK, Ghose KC (1983) Food preference and feeding behaviour of two pestiferous snails, Achatina fulica Bowdich and Macrochlamys indica Godwin-Austen. Rec zool surv India 80:421–440. https://doi.org/10.26515/rzsi/v80/i3-4/1982/161204
Raut SK, Ghose KC (1979) Factor influencing mortality in land snails, Achatina fulica Bowdich and Macrochlamys indica Godwin-Austen during aestivation. Proc Zool Soc 32:107–120.
Roda A, Nachman G, Weihman S, et al (2016) Reproductive ecology of the giant African snail in south Florida: Implications for eradication programs. PLoS One 11:1–18. https://doi.org/10.1371/journal.pone.0165408
Salles ACA, Oliveira CDC, Absalão RS (2018) Redescription of the jumping snail Ovachlamys fulgens (Glide, 1900) (Gastropoda: Helicarionoidea: Helicarionidae): An anatomical and conchological approach. Nautilus (Philadelphia) 132:19–29.
Talamas E.J. (2020) Pest Alert: Horntail Snail, Macrochlamys indica Benson.
Unknown author Chapter 3 Life cycle of Macrochlamys indica p 42–75.



