Introducción
Las palmas son un componente importante de los paisajes urbanos de Florida. Las diferentes especies de palmas que crecen en diversas zonas de resistencia climática en toda Florida se enfrentan en su entorno a tensiones abióticas y bióticas. La pudrición basal de las palmas causada por Ganoderma, es una de las mayores preocupaciones de la industria del paisajismo. Esta enfermedad letal prevalece en las regiones productoras de palmeras de EE. UU., y se cree que todas las especies de palmeras son susceptibles a este hongo. La pudrición basal de las palmas causada por Ganoderma es una enfermedad de lento avance. La muerte de la palma puede tomar de 6 meses a un año una vez que los síntomas iniciales aparecen. Esta enfermedad tradicionalmente ha sido diagnosticada en base a la presencia de cuerpos fructíferos o esporocarpos del hongo emergiendo del tronco de la palma. Pero con la disponibilidad de nuevas técnicas de diagnóstico de enfermedades, este hongo patógeno puede detectarse a partir de muestras de aserrín recolectadas de palmas sintomáticas, varios meses antes de que emerja el cuerpo fructífero del hongo.
Esta publicación servirá como guía para paisajistas profesionales y cualquier ciudadano interesado que necesite recolectar y someter muestras de aserrín de palmas al Laboratorio de Micología de Palmas para detectar la presencia de Ganoderma zonatum. Recolectar las muestras correctamente es un paso crítico para asegurar la validez de los resultados de la prueba de diagnóstico.
Recolecte muestras de buena calidad siguiendo los pasos a continuación y asegurándose de seguir las indicaciones asociadas con cada paso.
Recolección de muestras
El síntoma inicial en una palma afectada por pudrición basal causada por Ganoderma, es la desecación de las hojas de la parte inferior de la corona foliar. Para muestrear una palma sintomática, se recomienda recolectar las muestras de aserrín más cercanas a la línea del suelo, por encima del saliente de la raíz (Figura 1C). El patógeno causante de la enfermedad, el hongo Ganoderma zonatum, usualmente entra a través de las raíces y coloniza el tronco, por lo cual es más factible detectarlo cerca de la línea del suelo. La ubicación de la toma de muestra es la diferencia clave entre el muestreo para la detección de Ganoderma y para fitoplasmas.

Credit: Crédito: Braham Dhillon, UF/IFAS
Las siguientes piezas de equipo son necesarias para recolectar las muestras de aserrín del tronco de la palma:
- un taladrado eléctrico
- una broca de 7/32 pulgadas, de 6 a 8 pulgadas de largo
- un soplete de propano (para esterilizar la broca)
- agua destilada
- palillos de dientes (para remover tejido del tronco de la broca del taladro)
- tees de golf
- martillo
- bolsas plásticas sellables para contener la muestra
- un marcador permanente
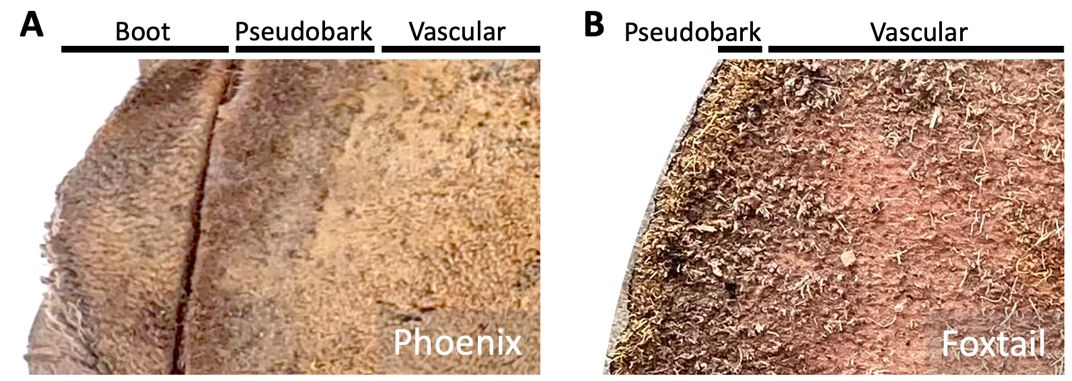
Mientras taladra el hueco en el tronco, asegúrese de que el taladro atraviesa la pseudocorteza (Figura 2). La parte más externa del tronco de las palmas se llama pseudocorteza (Figura 2), la cual es un tejido muerto que cubre y protege el tronco vivo. En las palmas de tronco liso, como las palmas cola de zorro o reina, esta pseudocorteza es muy delgada y fácil de perforar (Figura 2).
Credit: Crédito: foto de John Conroy, Fish Branch Tree Farm Inc., y adaptada por Braham Dhillon, UF/IFAS
Pero en las palmas donde las bases de las hojas, también llamadas botas, se quedan adheridas al tronco, como en el caso de las palmas Sabal, Washingtonia o Phoenix, recolecte las muestras de tejido taladrandro entre las botas o pasando el tejido de la bota (Figura 2). Una vez que la broca haya pasado el tejido de la pseudocorteza, retire la broca, y con un palillo esterilizado limpie y deseche los restos de tejido adheridos. Luego continue con la perforación en el mismo orificio, perfore de 1 a 2 pulgadas entrando al tejido vascular. Mientras perfora, sostenga la bolsa de plástico sellable debajo del taladro y recoja el tejido mientras la broca se retira del tronco. Los agujeros perforados se pueden sellar con tees de golf.
Recolecte al menos dos muestras del tronco, si la muestra 1 corresponde a un lado del árbol, recolecte la muestra 2 del otro lado diagonalmente opuesto. Ambas muestras pueden ser almacenadas en la misma bolsa de plástico. La prueba requiere de por lo menos de 1 a 2 cucharadas de muestra de aserrín. Etiquete la bolsa plástica con la fecha, la especie de palma y el nombre del sitio de recolección (Figura 1D). En el campo, almacene las muestras en hielo y lejos de la luz solar. Las muestras deben permanecer almacenadas en el refrigerador hasta el momento del envío.
En algunos casos, taladrar el orificio a la profundidad deseada no es posible si el tejido exterior del tronco es muy denso. Perforar continuamente en el mismo lugar sin aumentar la profundidad provoca que el tejido se caliente, lo cual no es deseable. En tales casos, saque la broca, recolecte la muestra y regrese al mismo orificio para recolectar muestra adicional.
Cuando se recolectan muestras de varias palmas, se recomienda esterilizar con un soplete o llama la broca del taladro (Figura 1) para evitar la contaminación cruzada. Asegúrese de esperar y dejar que el taladro se enfríe antes de recolectar la próxima muestra. Puede sumergir la broca o mecha del taladro en agua esterilizada para acelerar el enfriamiento.
Envío de las muestras
Cuando se envían las muestras para ser analizadas, es necesario completar y adjuntar un formulario con información relevante concerniente al sitio de colecta. Este formulario está disponible en este link que pertenece a la página del Fort Lauderdale Research and Education Center: https://flrec.ifas.ufl.edu/media/flrecifasufledu/palms/documents/palm_submission_form_fungalDiseases.pdf
Las muestras deben de ser enviadas a la siguiente dirección:
Attn: Palm Mycology Lab
UF/IFAS Fort Lauderdale Research and Education Center
3205 College Ave
Davie FL 33314