Nematodos parásitos de plantas
Los nematodos fitoparásitos son gusanos redondos microscópicos que se alimentan de tejido vegetal. La mayoría de los nematodos parásitos de plantas viven en el suelo y atacan las raíces de las plantas. Esto puede reducir el rendimiento al reducir la función de las raíces y, en consecuencia, el crecimiento de las plantas. Los cultivos de col son plantas seleccionadas de la familia Brassicaceae cuyas hojas o brotes se cosechan. Incluyen repollo, brócoli, coles de Bruselas, coliflor, berza y otros. Muchos géneros y especies diferentes de nematodos causan daños en la producción de cultivos de coles en Florida (Rhoades 1986; McSorley y Dickson 1995; Perez et al. 2000b). En muchos casos, una comunidad mixta de nematodos fitoparásitos está presente en un campo, en lugar de una sola especie. Las plagas de nematodos más importantes de los cultivos de coles en Florida son las especies de nematodos agalladores (Meloidogyne spp.), nematodos de aguijones (Belonolaimus longicaudatus), nematodos de raíces escoba de bruja (principalmente Nanidorus minor) y nematodos punzón (Dolichorus spp.). Para obtener más información sobre estos nematodos, consulte las siguientes publicaciones sobre el nematodo aguijón (Crow 2018; Crow y Brammer 2018), los nematodos de raíz escoba de bruja (Crow 2017). El nematodo del quiste de la remolacha azucarera (Heterodera schachtii) ha sido un problema serio en áreas locales del centro de Florida (Rhoades 1970). Varios otros nematodos están asociados con los cultivos de coles, pero su impacto en el rendimiento es bajo o desconocido.
Los nematodos fitoparásitos se pueden agrupar en función de sus hábitos de alimentación, lo que puede ser un factor importante en el diagnóstico y el manejo. Las etapas de la vida de los nematodos incluyen el huevo, cuatro etapas de juveniles pre- adultos y una etapa adulta madura. Todos los nematodos parásitos de las plantas tienen un estilete, que es una pieza bucal en forma de aguja que es típicamente hueca y se utiliza para extraer nutrientes de la planta huésped. Los ectoparásitos migratorios (Figura 1) son móviles y solo su estilete ingresa a la raíz mientras se alimenta; el resto del cuerpo permanece afuera (ectoparásito). Estos nematodos se mueven de un sitio de alimentación de raíces a otro. Los nematodos de aguijón, raíz escoba de bruja y punzón son ectoparásitos migratorios. Los endoparásitos migratorios son móviles y se mueven de un sitio a otro cuando se alimentan, pero entran completamente en la raíz para alimentarse. El nematodo lesionador (Pratylenchus spp.) es un ejemplo de endoparásito migratorio (Figura 2). Los endoparásitos sedentarios ingresan a la raíz para alimentarse, pero inducen a la planta a formar un sitio de alimentación complejo y no se mueven de este sitio una vez que se establecen como hembras juveniles o adultas (Figura 3). La hembra de los endoparásitos sedentarios se agranda a medida que se alimenta y produce cientos de huevos. Los nematodos agalladores y de quiste son endoparásitos sedentarios.
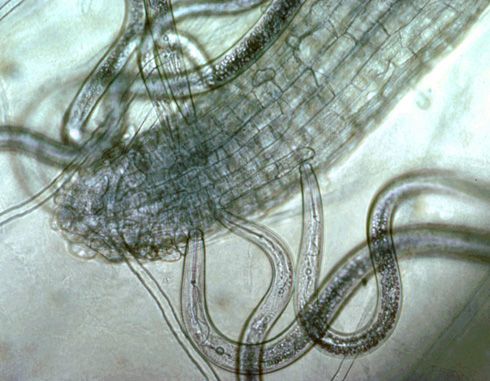
Credit: Ole Becker, Universidad de California Riverside. Usada con permiso.
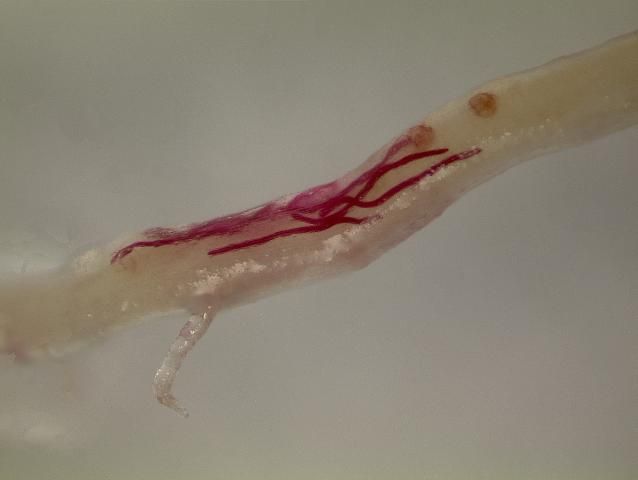
Credit: A. C. Hixson, UF/IFAS
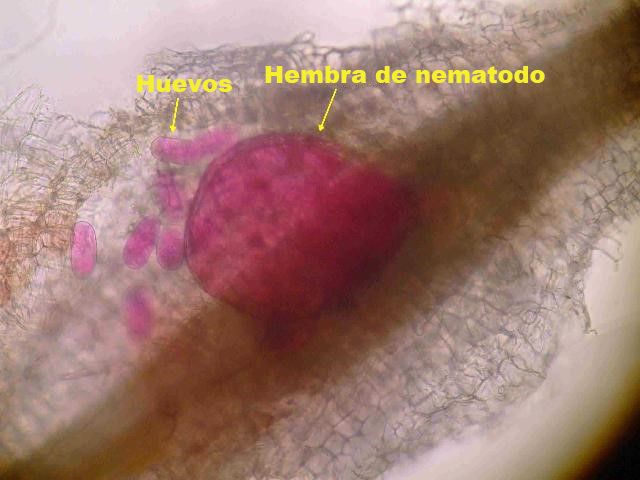
Credit: Credit: N. S. Sekora, UF/IFAS
Síntomas y daños
Lo ideal es monitorear síntomas para detectar posibles problemas de nematodos. La confirmación posterior mediante muestreo, como se describe en la siguiente sección, es generalmente necesaria porque los síntomas foliares del daño por nematodos pueden ser confusos y la pérdida de rendimiento puede ocurrir cuando hay pocos o ningún síntoma. Los síntomas típicos de lesión por nematodos pueden involucrar partes de plantas tanto aéreas como subterráneas. Los síntomas foliares, de la infestación de raíces por nematodos, generalmente involucran retraso en el crecimiento, marchitez prematura y recuperación lenta en mejores condiciones de humedad del suelo, clorosis de las hojas (coloración amarillenta) y otros síntomas característicos de deficiencia de nutrientes (Figura 4). En casos severos, partes de la planta pueden morir y volverse marrones (necrosis), o las plantas enteras pueden morir, resultando en una densidad reducida (Figura 5). Estos síntomas foliares severos, particularmente a principios de año, son típicos de la infestación por nematodos de aguijón (Figura 6). Por el contrario, los síntomas del nematodo agallador pueden ser más sutiles al principio de la temporada de crecimiento (marchitamiento, clorosis), con síntomas graves (retraso del crecimiento, necrosis) que se manifiestan más tarde en la temporada de crecimiento (Figura 7). Las plantas que presentan síntomas de atrofia o declive generalmente se encuentran en parches de crecimiento no uniforme, o distribución irregular que corresponden a diferentes abundancias de nematodos y condiciones ambientales (tipo de suelo, humedad, fertilidad). Los nematodos de raíz escoba de bruja transmiten “tobacco rattle virus”, una cepa del cual se sabe que afecta el cultivo de col espinaca en algunas regiones de los Estados Unidos (Kurppa et al. 1981). Los síntomas más distintivos de este virus en la col espinaca son manchas y salpicaduras de color amarillo brillante, pero también puede ocurrir necrosis y clorosis generalizada.

Credit: Zane Grabau, UF/IFAS

Credit: Joe Noling, UF/IFAS

Credit: Joe Noling, UF/IFAS

Credit: Zane Grabau, UF/IFAS
Los síntomas de las raíces inducidos por los nematodos de aguijón o los nematodos agalladores suelen ser más específicos que los síntomas de la superficie. El nematodo de aguijón puede ser muy dañino, haciendo que las plantas infectadas formen un tejido apretado de raíces cortas que a menudo están hinchadas en las puntas (Figura 8). Las nuevas raíces a menudo mueren por infestaciones intensas del nematodo de aguijón, que se asemeja a la quemadura por fertilizante (Figura 9). Los síntomas de las raíces inducidos por los nematodos agalladores incluyen áreas hinchadas (agallas) en las raíces de las plantas infectadas (Figura 10). El tamaño de las agallas puede variar desde unas pocas hinchazones esféricas hasta áreas extensas de hinchazones tumorales alargadas, complejas, que resultan de la exposición de múltiples y repetidas infecciones debido a la abundancia de nematodos agalladores. Los síntomas de agallas de raíces o tubérculos pueden proporcionar una confirmación diagnóstica positiva de la presencia de nematodos agalladores, la gravedad de la infección y el potencial de daño a los cultivos en la mayoría de los casos.
El momento y la gravedad de los síntomas de daño por nematodos están relacionados con la densidad de población de nematodos, las especies de nematodos fitoparásitos presentes, la susceptibilidad de los cultivos y las condiciones ambientales predominantes. El nematodo aguijón es muy dañino incluso en escasa abundancia, y los síntomas generalmente aparecen al principio de la temporada. En contraste, los cultivos de coles tienen una tolerancia algo mayor a los nematodos agalladores y los síntomas tienden a aparecer más tarde en el año. Cuanto más severa es la presión de los nematodos (mayor es la abundancia), más tempranos y severos son los síntomas. En niveles de infestación menos graves, la expresión de los síntomas puede retrasarse hasta más tarde en la temporada de cultivo, después de que se hayan completado varios ciclos reproductivos de nematodos en el cultivo. En este caso, los síntomas en la superficie no siempre serán evidentes en las primeras etapas del desarrollo del cultivo, pero con el tiempo y la reducción del tamaño y función del sistema radicular, los síntomas pueden volverse más pronunciados y más fácil de diagnosticar. En algunos casos, los síntomas del daño pueden ser demasiado sutiles para detectarlos, incluso si está ocurriendo pérdida de rendimiento.
Los nematodos parásitos de plantas reducen el rendimiento de los cultivos de coles al afectar la función de las raíces, lo que reduce el crecimiento y, en consecuencia, reduce el rendimiento. La raíz deteriorada reduce la absorción de agua y nutrientes, lo que afecta el crecimiento de las plantas (Figura 11). Los síntomas de daño y la pérdida de rendimiento generalmente aumentan a medida que incrementan los niveles de infestación de un nematodo en particular. El estrés ambiental (sequía, baja fertilidad, otras enfermedades, etc.) agrava el daño. Además, el potencial de daño varía según el nematodo. Por ejemplo, unos pocos nematodos de aguijón pueden causar una pérdida sustancial de rendimiento, mientras que unos pocos cientos de nematodos lesionadores provocan una pérdida mínima de rendimiento. La susceptibilidad y tolerancia a un nematodo en particular varían según el cultivo (se dice que un cultivo en el que un nematodo puede reproducirse y causar daño es susceptible a ese nematodo; un cultivo capaz de mantener el rendimiento a pesar de la infección y reproducción del nematodo es tolerante a ese nematodo). Un resumen de la susceptibilidad de cultivos de coles comunes en Florida a nematodos parásitos de plantas se provee en el Cuadro 1, pero no todas las combinaciones han sido probadas. Además, para la mayoría de las combinaciones de cultivos de coles y nematodos, las funciones de daño (pérdida de rendimiento esperada a varios niveles de población de nematodos) para un nematodo dado no se han determinado con precisión. Los cultivos de temporada más larga que se cultivan en meses más cálidos tienden a tener mayor riesgo de daño por nematodos porque estas condiciones favorecen el aumento de poblaciones de nematodos.

Credit: Zane Grabau, UF/IFAS

Credit: Zane Grabau, UF/IFAS

Credit: Zane Grabau, UF/IFAS

Credit: Zane Grabau, UF/IFAS
Diagnóstico de campo y muestreo
Generalmente el muestreo de suelo / tejido y el envío a un laboratorio de diagnóstico de nematodos profesional, como el Laboratorio de Evaluación de Nematodos “UF/IFAS Nematode Assay Laboratory”, se requiere para confirmar los problemas de nematodos. El muestreo de nematodos es (1) predictivo: determina el riesgo de daño por nematodos antes de plantar un cultivo determinado, o (2) diagnóstico: determina si los síntomas de la enfermedad en un cultivo son causados por nematodos. Se deben tomar muestras predictivas antes de plantar el cultivo porque las tácticas actuales de manejo de nematodos deben implementarse en o antes de la siembra. De manera similar, las muestras de diagnóstico son útiles para planificar el manejo de cultivos posteriores, pero son demasiado tardías para el cultivo actual. La recolección y presentación adecuada de muestras mediante los siguientes pasos es clave para un diagnóstico exitoso de nematodos.
- Siempre incluya una muestra de suelo cuando evalúe nematodos. Complementar con muestras de raíces, si las plantas crecen en el campo, también puede ser útil para la evaluación, pero el suelo es esencial. El suelo es imprescindible porque algunos nematodos (ectoparásitos) solo se pueden detectar en el suelo porque no entran completamente en las raíces y es posible que no se detecten en las muestras de raíces. Todos los nematodos tienen al menos una etapa de vida que se puede encontrar en el suelo.
- El mejor momento para tomar muestras predictivas es justo antes de la cosecha del cultivo anterior porque es cuando la abundancia de nematodos es mayor y cuando esta plaga es más fácil de detectar. Tome muestras de diagnóstico cuando aparezcan los síntomas. Muestree solo cuando la humedad del suelo sea apropiada para trabajar en el campo. Evite las condiciones de suelo extremadamente seco o húmedo porque será difícil detectar nematodos en estas muestras.
- Recolecte muestras de suelo de 10 a 20 ubicaciones de campo utilizando un tubo de muestreo cilíndrico, una palita o una pala. Debido a que la mayoría de las especies de nematodos se concentran en la zona de raíces del cultivo, las muestras deben recolectarse a una profundidad del suelo de al menos 6 a 12 pulgadas. Si las plantas crecen en el campo, recolecte muestras de suelo a unas pocas pulgadas de las plantas para inspeccionar la zona de enraizamiento donde la abundancia de nematodos es mayor. Debido a que la abundancia de nematodos es irregular, recolecte muestras de múltiples ubicaciones dentro de un campo para obtener una muestra representativa. Recolecte muestras de raíces de manera similar.
- Si toma muestras en campos en barbecho o en un cultivo sin síntomas obvios de nematodos, muestree en un patrón regular en un área de no más de 5 acres, enfatizando la extracción de muestras transversalmente en lugar de a lo largo de las filas. Si el muestreo se realiza en un campo sintomático, concentre el muestreo en áreas con plantas enfermas, pero no muertas (es posible que las poblaciones de nematodos ya hayan disminuido en áreas con plantas muertas porque su fuente de alimento se ha ido). También puede ser útil recolectar una muestra de un área sana del campo para fines de comparación.
- Una vez que se hayan recolectado todos los núcleos de suelo para una sola muestra, se debe mezclar minuciosamente toda la muestra, pero con cuidado y se debe colocar una submuestra de 1 a 2 pinta en una bolsa de plástico debidamente etiquetada. La bolsa de plástico evitará que la muestra se seque y ayudará a garantizar que esté intacta cuando llegue al laboratorio. Nunca someta la(s) muestra(s) a sobrecalentamiento, congelación, secado, períodos prolongados de luz solar directa o daños mecánicos como arrojar las bolsas. Si es posible, almacene las muestras en una hielera en el campo y transfiéralas a un refrigerador a 40-60 ° F hasta su envío.
- Las muestras de raíces deben manipularse de manera similar. Si envía muestras de raíces, seleccione entre 2 y 5 de las raíces más sintomáticas (según el tamaño de la planta). El envío de muestras de raíces puede ser útil para diagnosticar daños en función de los síntomas, incluso si no tiene la intención de cuantificar los nematodos de las raíces. Si no puede enviar las raíces por correo, es útil tomar fotografías de las raíces sintomáticas y enviarlas por correo electrónico. De manera similar, las imágenes de los síntomas foliares son útiles para la evaluación.
- Si es posible, envíe las muestras el mismo día de la recolección mediante el método de entrega más rápido posible. Las muestras pueden estar expuestas a condiciones perjudiciales para los nematodos durante el envío, por lo que los períodos de entrega más largos pueden reducir la recuperación de los nematodos. Evite el envío de varios días durante el fin de semana. Espere para enviar estas muestras hasta principios de semana. Almacene las muestras a una temperatura de 40°F a 60°F si necesita esperar para enviarlas.
- Asegúrese de proporcionar información precisa y completa en los formularios, particularmente sobre el historial del cultivo, los síntomas y las prácticas de manejo de nematodos. Esta información ayudará a fundamentar las recomendaciones.
Para cada muestra enviada, el Laboratorio de Evaluación de Nematodos “UF/IFAS Nematode Assay Laboratory” proporcionará un informe de los géneros y la cantidad de nematodos parásitos de plantas en cada muestra, así como una evaluación del riesgo de daños y recomendaciones de manejo. Comuníquese con su agente de extensión local o con Z. J. Grabau para obtener ayuda con el muestreo de nematodos o para una consulta de campo. La evaluación de la incidencia y la gravedad de los síntomas de las raíces, en particular el agallamiento, que es un diagnóstico de los nematodos agalladores, puede ser una herramienta valiosa para diagnosticar la gravedad y la ubicación en el campo del problema de los nematodos y el laboratorio de ensayos de nematodos de UF / IFAS puede ayudar con esto.
Manejo de Nematodos
Las estrategias de manejo de nematodos se basan en reducir la abundancia de nematodos para reducir el daño a los cultivos, o elegir un cultivar que sea resistente o tolerante a un nematodo en particular. Las principales estrategias de manejo de nematodos incluyen (1) uso de cultivares resistentes o tolerantes, (2) rotación de cultivos y otras prácticas culturales, (3) aplicación de nematicidas y (4) control biológico. No todas las prácticas de manejo son igualmente efectivas para controlar los nematodos parásitos de plantas y los costos también varían. Cuando sea posible, se deben integrar múltiples estrategias de manejo como parte de un enfoque de sistemas. Las especies y la abundancia de nematodos parásitos de las plantas en un campo determinado influirán en qué prácticas son más efectivas o necesarias, por lo que el muestreo es una parte importante de la selección de una estrategia de manejo de nematodos. Las operaciones de los productores (capacidad de rotación, equipo y estrategia de insumos) también determinan qué gestión se puede utilizar.
Cultivar y Selección de Trasplante
El uso de trasplantes libres de nematodos es una consideración importante para el manejo de nematodos en cultivos de coles. La infestación de nematodos en la etapa de trasplante es particularmente problemática porque cuanto antes se infestan las plantas, mayor es el daño final. Para asegurarse que los trasplantes estén libres de nematodos, use trasplantes cultivados en material para sustrato de macetas o suelo que sea manejado adecuadamente contra nematodos, idealmente con un fumigante.
El riesgo de daño por nematodos puede variar según el cultivo y el cultivar de coles, y esta escogencia es parte del manejo de nematodos. La mayor parte de esta variación se debe al estado como hospedero y a la tolerancia relativa de un cultivo de col en particular. La susceptibilidad de los cultivos de coles comunes a varios nematodos se resume en la Cuadro 1 y se puede utilizar como guía para ayudar en la selección de cultivos. La tolerancia a los nematodos de los cultivares actuales de col no está bien descrita. Los cultivares resistentes reducen o eliminan la reproducción de un nematodo específico, lo que permite que el cultivar escape al daño y que se reduzca la abundancia de nematodos para el próximo cultivo. No se conocen cultivares de col con resistencia a ningún género de nematodos en Florida, y no se ha realizado una prueba formal para la mayoría de las combinaciones de cultivos y nematodos.
Rotación de Cultivos
Cuando sea posible, la rotación de cultivos con cultivos no relacionados es una buena práctica para reducir las poblaciones de nematodos. La rotación con cultivos comerciales durante la temporada de crecimiento típica, o con cultivos de cobertura que no se cosechan para la venta durante los períodos típicamente de barbecho, son beneficiosos. Cuando se planta, en un campo determinado, un cultivo que no es hospedero, o es un hospedero pobre de los nematodos, las poblaciones de nematodos disminuirán de manera constante con el tiempo. Además, ciertos cultivos producen aleloquímicos que pueden reducir activamente las poblaciones de nematodos. La crotalaria (“Sunn hemp”) y la mucuna (“Velvet bean”) son posibles cultivos de cobertura de verano que se sabe que producen aleloquímicos que pueden tener efectos nematicidas. Los propios cultivos de col también contienen posibles aleloquímicos, pero se han selecionado para reducir las concentraciones de estos compuestos porque las personas los encuentran desagradables. Incluso para cultivos que producen aleloquímicos, es importante considerar el estado como hospedero del cultivo, porque la producción de un cultivo hospedero puede anular cualquier beneficio de los aleloquímicos para el manejo de nematodos en el próximo cultivo. La cantidad de tiempo que se necesita rotar un campo a un cultivo no hospedero para reducir las poblaciones de nematodos por debajo de un nivel de daño variará según muchos factores, incluidas las poblaciones iniciales de nematodos, las condiciones ambientales y otras prácticas de manejo utilizadas. A menudo, se necesitan varias temporadas de cultivos no hospederos para reducir las poblaciones de nematodos por debajo de un nivel de daño.
No es posible encontrar cultivos de rotación o de cobertura que reduzcan las poblaciones de todas las plagas de nematodos de los cultivos de coles, por lo que es importante determinar qué especies de nematodos están presentes en un campo determinado. Cuando hay varias especies presentes, a menudo es útil diseñar la rotación de cultivos para reducir los nematodos agalladores, los nematodos más difíciles de controlar con productos químicos. El Cuadro 1 resume el estado como hospedero reportado para algunos cultivos de cobertura o rotación comunes para los principales nematodos de los cultivos de col en Florida. Tenga en cuenta que las interacciones nematodo-cultivo pueden variar según el cultivo y la población de nematodos, por lo que el éxito del manejo de un cultivo en un campo en particular puede variar de lo que se informa en la literatura. Los pastos, como el maíz o el sorgo-pasto sudan, son excelentes huéspedes de nematodos de aguijón y de nematodos de las raíces escoba de bruja y deben evitarse si es posible cuando estos nematodos están presentes. Ciertos cultivos de cobertura de verano, como la crotalaria, mucuna y el añil (“Hairy indigo”), pueden ser útiles para el manejo de los nematodos de aguijón. La mayoría de los cultivos comerciales comúnmente rotados con cultivos de coles son hospederos de los tres principales nematodos agalladores en Florida (M. incognita, M. arenaria, M. javanica) excepto por algunos cultivos (soja, tomate y pimientos) para los cuales se encuentran cultivares resistentes disponibles. Se ha informado que varios cultivos de cobertura de verano (crotalaria, sorgo-pasto sudan, mucuna, añil y dormilonga (“American jointvetch”) son hospederos pobres de nematodos agalladores y pueden ser útiles para el manejo de estos nematodos. Para obtener más información, consulte estas publicaciones sobre la producción de cultivos de cobertura de Florida (Wright et al. 2017), cultivos de cobertura para el nematodo agallador (Gill y McSorley 2017) y el manejo de nematodos utilizando cáñamo solar (Wang y McSorley 2018a), caupí (Wang y McSorley 2018b), y sorgo-pasto sudan (Dover et al. 2018). Para obtener más orientación sobre la posible rotación o cultivos de cobertura para el manejo de nematodos, comuníquese con su agente de extensión local o con Z. J. Grabau.
Cuadro 1. Estado como hospedero, de cultivos de cobertura comerciales y de verano, de comunes nematodos parásitos de plantas en cultivos de coles en Florida. 1
OtrasPrácticasCulturales
El manejo adecuado de las malezas es un componente importante del manejo de los nematodos porque las malezas pueden servir como hospederas para los nematodos parásitos de plantas y aumentar o mantener las poblaciones durante el barbecho o cuando se cultiva un cultivo no hospedero. Por ejemplo, el coquillo (“nutsedge”), el amaranthus (“pigweed”) y el cenizo (“lambsquarter”), entre muchos otros, son generalmente buenos huéspedes de nematodos agalladores. Además, los cultivos deben terminarse mediante la aplicación de herbicidas o la labranza tan pronto como sea posible después de la cosecha para asegurar la muerte y la desecación o descomposición de todas las raíces de la planta hospedante. Si los cultivos se dejan en el campo después de la cosecha, los nematodos pueden continuar reproduciéndose en sus raíces después de la cosecha. El barbecho limpio también puede reducir las poblaciones de nematodos porque elimina las plantas hospedantes, pero también conlleva el riesgo de erosión del suelo. La labranza puede contribuir a reducir la abundancia de nematodos porque calienta, seca y perturba mecánicamente el suelo. Finalmente, cualquier práctica que promueva la salud de las plantas, como el riego adecuado, el mantenimiento de la fertilidad del suelo y el manejo de otras enfermedades puede aumentar la tolerancia de las plantas a los nematodos.
Control Químico
La mayoría de los campos en los que los nematodos han dañado previamente los cultivos de coles, u otros cultivos, deben tratarse con nematicidas para mejorar la producción de cultivos de coles. Esto es especialmente cierto en tierras altamente cultivadas con cultivos de coles y otros cultivos susceptibles a los mismos nematodos. La selección de un nematicida debe basarse en los tipos de nematodos y enfermedades transmitidas por el suelo presentes en el campo, la susceptibilidad de un cultivo específico de col, las condiciones del campo en el momento de la preparación del suelo y el mercado previsto (grado de control necesario).
Control Biológico
El control biológico utiliza organismos vivos para manejar plagas. Los organismos de control biológico utilizados contra los nematodos producen sustancias químicas perjudiciales para los nematodos o los parasitan directamente. Un método de control biológico es un enfoque inundativo, en el que los organismos de control biológico se introducen en el campo, generalmente como un producto comercial. En los Cuadros 2 y 3 se enumeran dos productos que podrían considerarse métodos de control biológico: Majestene y MeloCon WG. Majestene está hecho de bacterias muertas Burkholderia y el producto de fermentación en el que se cultivó la bacteria. Debido a que Majestene no contiene organismos vivos, en principio, es similar a los nematicidas químicos no fumigantes, en que se basa en el material nematicida que entra en contacto con los nematodos. Melocon WG contiene hongos Purpureocillium lilacinum vivos, por lo que su eficacia depende no solo de una distribución adecuada en el suelo, sino también de que las condiciones sean favorables para que los hongos se establezcan en el medio ambiente e infecten a los nematodos.
Un segundo enfoque del control biológico es el uso de organismos que son nativos del suelo. Se conoce que muchos organismos de control biológico residen en el suelo y hay ubicaciones en el campo que inhiben los nematodos (las poblaciones de nematodos se mantienen más bajas de lo esperado a pesar de estar en un cultivo susceptible). La supresión a menudo está relacionada con el monocultivo sin fumigantes de amplio espectro u otros pesticidas que afectan a las comunidades de microbios. El monocultivo no se recomienda como método de control biológico porque no hay garantía de que se produzca la supresión; requiere sostener un período de intensa presión de nematodos; y existen otras sanciones agronómicas a el monocultivo. La labranza reducida y el mayor aporte de materia orgánica, como los cultivos de cobertura minucioso, pueden inducir el control biológico, pero actualmente no existe una fórmula confiable para hacer esto para los cultivos de Florida.
Cuadro 2. Productos no fumigantes para el cultivo de col en Florida.
Cuadro 3. Characteristicas de productos no-fumigantes en cultivos de coles en Florida.
Referencias
Anwar, S. A. and M. V. McKenry. 2010. “Incidence and Reproduction of Meloidogyne incognita on Vegetable Crop Genotypes.” Pakistan Journal of Zoology 42: 135–141.
Carneiro, R. M. D. G., O. Randig, M. R. A. Almeida, and A. D. Campos. 2000. “Resistance of Vegetable Crops to Meloidogyne spp.: Suggestion for a Crop Rotation System.” Nematologia Brasileira 24: 49–54.
Crow, W. T. 2017. Stubby-Root Nematode, Nanidorus minor (colbran) Siddiqi (syn. Paratrichodorus minor, P. christiei, Trichodorus minor, T. christiei) (Nematoda: Adenophorea: Triplonchida: Diphtherophorina: Trichodoridea: Trichodoridae). ENY-339. Gainesville: University of Florida Institute of Food and Agricultural Sciences. https://edis.ifas.ufl.edu/in616
Crow, W. T., D. P. Weingartner, D. W. Dickson, and R. McSorley. 2001. “Effect of Sorghum-Sudangrass and Velvetbean Cover Crops on Plant-Parasitic Nematodes Associated with Potato Production in Florida.” Journal of Nematology 33: 285–288.
Crow, W. T. 2018. Belonolaimus longicaudatus Rau (Nematoda: Secernentea: Tylenchida: Tylenchina: Belonolaimidae: Belonolaiminae). ENY-239. Gainesville: University of Florida Institute of Food and Agricultural Sciences. https://edis.ifas.ufl.edu/in395
Crow, W. T., and B. S. Brammer. 2018. Awl nematodes, Dolichodorus spp. Cobb, 1914 (Nematoda: Secernentea: Tylenchida: Tylenchina: Dolichodoridae: Dolichodorinae). ENY-241. Gainesville: University of Florida Institute of Food and Agricultural Sciences. https://edis.ifas.ufl.edu/in397
Crow, W. T. 2013. “Effects of a Commercial Formulation of Paecilomyces lilacinus Strain 251 on Overseeded Bermudagrass Infested with Belonolaimus longicaudatus.” Journal of Nematology 45: 223.
Culbreath, A. K., R. Rodriguez-Kabana, and G. Morgan-Jones. 1986. “Chitin and Paecilomyces lilacinus for Control of Meloidogyne arenaria.” Nematropica 16: 153–166.
Desaeger, J. A., and T. T. Watson. 2019. “Evaluation of New Chemical and Biological Nematicides for Managing Meloidogyne javanica in Tomato Production and Associated Double Crops in Florida.” Pest Management Science 75: 3363–3370. https://doi.org/10.1002/ps.5481
Di Vito, M., N. Vovlas, and P. Castillo. 2004. “Host–Parasite Relationships of Meloidogyne incognita on Spinach.” Plant Pathology 53: 508–514. https://doi.org/10.1111/j.1365-3059.2004.01053.x
Dias-Arieira, C. R., T. P. da Cunha, F. M. Chiamolera, H. H. Puerari, F. Biela, and S. d. M. Santana. 2012. “Reaction of Vegetables and Aromatic Plants to Meloidogyne javanica and M. incognita.” Horticultura Brasileira 30: 322–326. https://doi.org/10.1590/S0102-05362012000200023
Dover, K., K. H. Wang, and R. McSorley. 2018. Nematode Management Using Sorghum and Its Relatives. ENY-716. Gainesville: University of Florida Institute of Food and Agricultural Sciences. http://edis.ifas.ufl.edu/in531
Gill, H. K., and R. McSorley. 2017. Cover Crops for Managing Root-Knot Nematodes. ENY-063. Gainesville: University of Florida Institute of Food and Agricultural Sciences. http://edis.ifas.ufl.edu/in892
Grabau, Z. J., and C. Liu. 2019a. “Fumigant and Non-Fumigant Nematicides for Root-Knot Nematode Management in Florida Tomato, 2018.” Plant Disease Management Reports 13: N004. http://www.plantmanagementnetwork.org/pub/trial/PDMR/volume13/
Grabau, Z. J., and C. Liu, C. 2019b. “Impact of Nematicide Application on Root-Knot Nematode Management in Florida Spring Watermelon.” Plant Disease Management Reports 13: N006. http://www.plantmanagementnetwork.org/pub/trial/PDMR/volume13/
Grabau, Z. J., J. W. Noling, and P. A. Navia Gine. 2019. “Fluensulfone and 1,3-Dichloroprene for Plant-Parasitic Nematode Management in Potato Production.” Journal of Nematology 51: UNSP e2019–38. https://doi.org/10.21307/jofnem-2019-038
Hewlett, T. E., D. W. Dickson, D. J. Mitchell, and M. E. Kannwischer-Mitchell. 1988. “Evaluation of Paecilomyces lilacinus as a Biocontrol Agent of Meloidogyne javanica on Tobacco.” Journal of Nematology 20: 578.
Khan, A. A. and M. W. Khan. 1991. “Penetration and Development of Meloidogyne incognita Race 1 and Meloidogyne javanica in Susceptible and Resistant Vegetables. Nematropica 21: 71–77.
Khan, T. A., M. S. Ashraf, and R. A. Dar. 2010. “Pathogenicity and Life Cycle of Meloidogyne javanica on Broccoli.” Archives of Phytopathology and Plant Protection 43: 602–608. https://doi.org/10.1080/03235400801972392
Kim, D., Y. Ryu, C. Huh, and Y. Lee. 2013. “Resistance of Newly Introduced Vegetables to Meloidogyne arenaria and M. incognita in Korea.” Research in Plant Disease 19: 294–299. https://doi.org/10.5423/RPD.2013.19.4.294
Kinloch, R. A., and L. S. Dunavin. 1993. “Summer Cropping Effects on the Abundance of Meloidogyne arenaria Race 2 and Subsequent Soybean Yield. Journal of Nematology 25: 806–808.
Kurppa, A., A. T. Jones, B. D. Harrison, and K. W. Bailiss. 1981. “Properties of Spinach Yellow Mottle, a Distinctive Strain of Tobacco Rattle Virus.” Annals of Applied Biology 98: 243–254.
Liu, C., and Z. J. Grabau. 2019. “Nematode Management at Different Nematicide Application Time in North Florida Tomato, 2018.” Plant Disease Management Reports 13: N010. http://www.plantmanagementnetwork.org/pub/trial/PDMR/volume13/
McSorley, R. 1994. Changes in Population-Densities of Meloidogyne spp and Paratrichodorus Minor on Winter Rye Cover Crops.” Nematropica 24: 151–160.
McSorley, R., and D. W. Dickson. 1995. “Effect of Tropical Rotation Crops on Meloidogyne incognita and Other Plant-Parasitic Nematodes.” Journal of Nematology 27: 535–543.
McSorley, R., D. W. Dickson, and J. A. DeBrito. 1994. “Host Status of Selected Tropical Rotation Crops to 4 Populations of Root-Knot Nematodes.” Nematropica 24: 45–53.
McSorley, R., and R. N. Gallaher. 1993. “Effect of Crop-Rotation and Tillage on Nematode Densities in Tropical Corn.” Journal of Nematology 25: 814–819.
McSorley, R., and J. J. Frederick. 1995. “Responses of Some Common Cruciferae to Root-Knot Nematodes.” Journal of Nematology 27: 550.
Perez, E. E., D. P. Weingartner, and R. McSorley. 2000a. “Correlation between Paratrichodorus minor Population Levels and Corky Ringspot Symptoms on Potato.” Nematropica 30: 247–251.
Perez, E. E., D. P. Weingartner, and R. McSorley. 2000b. Niche Distribution of Paratrichodorus minor and Belonolaimus longicaudatus Following Fumigation on Potato and Cabbage.” Journal of Nematology 32: 343–348.
Rhoades, H. L. 1971. “Chemical Control of Sting Nematode, Belonolaimus longicaudatus, on Direct-Seeded Cabbage.” Plant Disease Reporter 55: 412–414.
Rhoades, H. L. 1986. “Effects of Fumigant and Nonfumigant Nematicides on Belonolaimus longicaudatus and Hoplolaimus galeatus Populations and Subsequent Yield of Cabbage.” Plant Disease 70: 581–582.
Rhoades, H. L. 1987. “Effects of Fumigant and Nonfumigant Nematicides on Nematode Populations and Yields of Broccoli and Squash in Florida.” Nematropica 17: 193–198.
Rhoades, H. L. 1970. “Occurrence of the Sugarbeet Nematode, Heterodera schachtii, in Florida.” Plant Disease Reporter 54: 635.
Rodriguez-Kabana, R., J. Pinochet, D. G. Robertson, and L. Wells. 1992. “Crop-Rotation Studies with Velvetbean (Mucuna deeringiana) for the Management of Meloidogyne spp.” Journal of Nematology 24: 662–668.
Rodriguez-Kabana, R., D. B. Weaver, D. G. Robertson, R. W. Young, and E. L. Carden. 1990. “Rotations of Soybean with 2 Tropical Legumes for the Management of Nematode Problems.” Nematropica 20: 101–110.
Wang, K. H., R. J. McGovern, R. McSorley, and R. N. Gallaher. 2004. “Cowpea Cover Crop and Solarization for Managing Root-Knot and Other Plant-Parasitic Nematodes in Herb and Vegetable Crops.” Soil and Crop Science Society of Florida Proceedings 63: 99–104.
Wang, K. H., and R. McSorley. 2018a. Management of Nematodes and Soil Fertility with Sunn Hemp Cover Crop. ENY-717. Gainesville: University of Florida Institute of Food and Agricultural Sciences. http://edis.ifas.ufl.edu/ng043
Wang, K. H., and R. McSorley. 2018b. Management of Nematodes with Cowpea Cover Crops. ENY-712. Gainesville: University of Florida Institute of Food and Agricultural Sciences. http://edis.ifas.ufl.edu/in516
Watson, T. T., and J. A. Desaeger. 2019. “Evaluation of Non-Fumigant Chemical and Biological Nematicides for Strawberry Production in Florida.” Crop Protection 117: 100–107. https://doi.org/10.1016/j.cropro.2018.11.019
Weingartner, D. P., R. McSorley, R. and R. W. Goth. 1993. “Management Strategies in Potato for Nematodes and Soil-Borne Diseases in Subtropical Florida.” Nematropica 23: 233–245.
Wright, D. L., C. Mackowiak, and A. Blount. 2017. Cover Crops. SS-AGR-66. Gainesville: University of Florida Institute of Food and Agricultural Sciences. http://edis.ifas.ufl.edu/aa217